Пептиды. Электронное и пространственное строение пептидной связи.
ЗАНЯТИЕ 14
ПЕПТИДЫ И БЕЛКИ: СТРУКТУРА, КЛАССИФИКАЦИЯ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА. РАСТВОРЫ ВМС
Пептиды. Электронное и пространственное строение пептидной связи.
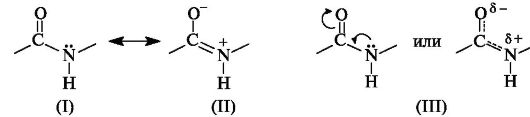
В пептидной (амидной) группе -СО-NH- атом углерода находится в состоянии sp2-гибридизации. Неподеленная пара электронов атома азота вступает в сопряжение с π-электронами двойной связи С=О. С позиций электронного строения пептидная группа представляет собой трехцентровую p,π-сопряженную систему, электронная плотность в которой смещена в сторону более электроотрицательного атома кислорода. Атомы С, О и N, образующие сопряженную систему, находятся в одной плоскости. Распределение электронной плотности в амидной группе можно представить с помощью граничных структур (I) и (II) или смещения электронной плотности в результате +M- и - M-эффектов групп NH и C=O соответственно (III).
В результате сопряжения происходит некоторое выравнивание длин связей. Двойная связь С=О удлиняется до 0,124 нм против обычной длины 0,121 нм, а связь С-N становится короче - 0,132 нм по сравнению с 0,147 нм в обычном случае (рис. 1). Плоская сопряженная система в пептидной группе служит причиной затруднения вращения вокруг связи С-N (барьер вращения составляет 63-84 кДж/моль). Таким образом, электронное строение предопределяет достаточно жесткую плоскую структуру пептидной группы.
Как видно из рис. 1, α-атомы углерода аминокислотных остатков располагаются в плоскости пептидной группы по разные стороны от связи С-N, т. е. в более выгодном тpанс-положении: боковые радикалы R аминокислотных остатков в этом случае будут наиболее удалены друг от друга в пространстве.
Полипептидная цепь имеет удивительно однотипное строение и может быть представлена в виде ряда расположенных под углом друг к другу плоскостей пептидных
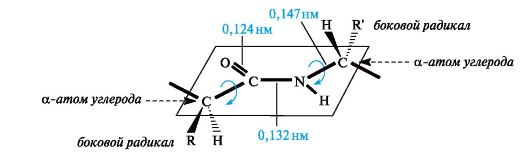
Рис. 1. Плоскостное расположение пептидной группы -CO-NH- и α-атомов углерода аминокислотных остатков
групп, соединенных между собой через α-атомы углерода связями Сα-N и Сα-Сsp2 (рис. 2). Вращение вокруг этих одинарных связей весьма ограничено вследствие затруднений в пространственном размещении боковых радикалов аминокислотных остатков. Таким образом, электронное и пространственное строение пептидной группы во многом предопределяет структуру полипептидной цепи в целом.
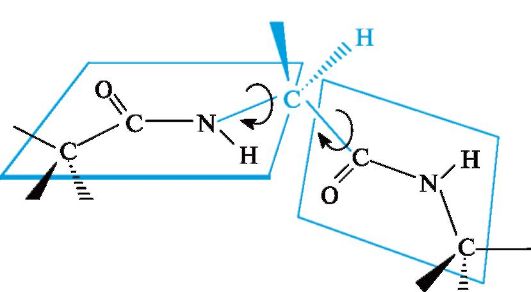
Рис. 2. Взаимное положение плоскостей пептидных групп в полипептидной цепи
Дата добавления: 2015-05-26; просмотров: 13044;
