Пят- и шестичленные циклы
Благодаря минимальным искажениям валентных углов и минимальному напряжению, обусловленному взаимодействием несвязанных групп, пяти- и шестичленные циклы (как и ведущие к ним переходные состояния) оказываются наиболее энергетически выгодными среди всех циклических систем. Это является одной из основных причин, обусловливающих тот хорошо известный факт, что образование такого рода циклических систем может протекать почти самопроизвольно, если к этому есть хоть малейшая возможность. В этих случаях практически исключаются конкурирующие межмолекулярные реакции, и практически все обычные методы создания связи С-С оказываются не только в принципе пригодными, но и реально применимыми для решения задач создания такого рода циклических фрагментов. Ниже мы рассмотрим лишь некоторые характерные примеры.
Внутримолекулярное взаимодействие енолятного нуклеофила и карбонильного электрофила, приводящее к образованию шестичленного цикла, — хорошо известная реакция 1,5-дикарбонильных соединений, являющаяся ключевой стадией в методе аннелирования по Робинсону (см. разд. 2.2.3,3). Как показано на схеме 2.108, в принципе в такой системе возможно образование не только производных циклогексана [путь (1)], но и альтернативное направление, приводящее к замыканию четырехчленного цикла [путь (2)], которое, однако, практически не реализуется.
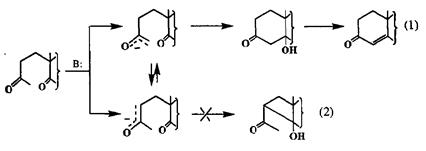 Схема 2.108
Схема 2.108
|
Столь же высока селективность внутримолекулярной альдольной конденсации 1,4-дикарбонильных соединений (например, дикетонов 282, схема 2.109), приводящей к исключительному образованию пятичленного цикла (альтернативное направление реакции в данной системе давало бы трехчленный цикл, что в общем случае энергетически несравненно менее выгодно). Подобная циклизация является одним из наиболее универсальных способов синтеза производных циклопентенона [29а].
 Схема 2.109
Схема 2.109
|
На схеме показан также пример селективного превращения 1,6-дикетона 283в соответствующий ацетилциклопентенон. В данном случае также не реализуется возможность протекания конкурентной реакции, которая должна была бы приводить к замыканию семичлснного цикла.
Типичные варианты синтезов требуемых 1,4-дифункциональных производных и юс последующей циклизации с образованием пятичленного цикла, основанные на химии карбонильных соединений, представлены на конкретных примерах на схеме 2.110 [29Ь]. Так, получение циклопентенона 284начинается с формил-анионного эквивалента 285,алкированием которого получают продукт 286.Последний далее по реакции Михаэля с метилвинилкетоном (с последующим удалением защиты кетонной функции) превращается в 1,4-дикетон 287,циклизация которого и дает целевой продукт [29с].
В коротком синтезе бициклического продукта 288[29d] дважды использовано двойное алкилирование 1,2-бис-енолятов. На первой стадии реакции бис-енолят диметилсукцината алкилируют 1,3-дибромпропаном, что приводит к построению первого циклопентанового фрагмента. На следующей стадии повторно генерируют 1,2-бис-енолят, который далее также алкилирует-ся бифункциональным электрофилом, в роли которого на этот раз выступает 4-бромбутанон-2.
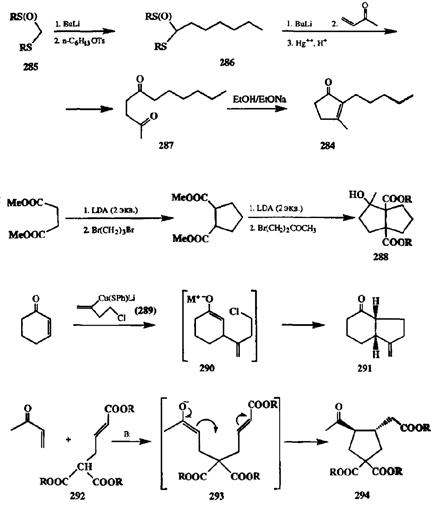 Схема 2.110
Схема 2.110
|
Бифункциональный реагент 289,содержащий нуклеофильную и электро-фильную фуппы, бьи разработан для построения циклопентанового фрагмента, содержащего экзометиленовую группу, по схеме реакции Михаэля. В этой схеме енолятный интермедиат 290,образующийся при взаимодействии циклогексенона с 289,немедленно реагирует с имеющимся в последнем хлоралкильным электрофилом, что и дает требуемый продукт 291[29е].
В довольно необычном бифункциональном реагенте 292 содержится мало-натная группировка и остаток а,|3-непредельного эфира. Первый из этих фрагментов «сработал» как С-нуклеофил в межмолекулярной реакции Михаэля с метилвинилкетоном, которая привела к образованию енолята 293.Благодаря наличию в этом интермедиате как енолятного фрагмента, так и группировки а,р-непредельного эфира, легко протекала внутримолекулярная реакция Михаэля, что и привело к образованию циклопентанового производного 294.Надо отметить, что реагент 292 был специально спроектирован с тем, чтобы проверить саму идею синтетического использования последовательности двух реакций Михаэля (межмолекулярной и внутримолекулярной) [29f|.
Эффективным методом синтеза циоопентенонов различного строения является катализируемая кислотами циклизация диен-1,4-онов-3, открытая более полувека назад и известная как реакция Назарова [29g] (см., например, превращение 295 в 296, схема 2.111). Первоначально синтетическая полезность метода ограничивалась необходимостью применения сильных кислот и довольно жестких условий проведения реакции. Однако очевидный синтетический потенциал этого превращения стимулировал разработку более приемлемых методик, благодаря чему к настоящему времени циклизация по Назарову превратилась в почти универсальный метод [29h]. Среди ряда методов получения субстратов для этой циклизации один из наиболее удобных основан на 1,2-присоединении виниллитиевых производных по карбонильной группе а,р-непредельных альдегидов, как это показано на схеме 2.111 на примере синтеза диенона 295.
Богатейшим источником для разработки методов синтеза циклических структур является химия комплексов переходных металлов. В разд. 2.6.3.4. мы рассмотрим некоторые обшие подходы к разработке и
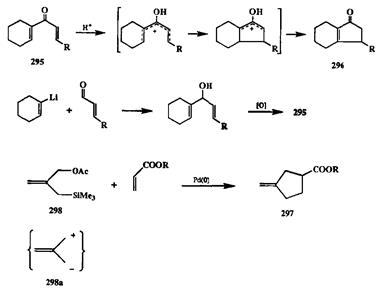 Схема 2.111
Схема 2.111
|
использованию таких методов, но один из примеров уместно рассмотреть в контексте обсуждаемого здесь материала. На схеме 2.111 показано образование метиленцикло-пентана 297в результате реакции эфира акриловой кислоты с бифункциональным реагентом 298. Идея этого синтеза предполагала, что реагент 298 может служить эквивалентом биполярного иона 298а,так называемого три-метиленметана, взаимодействие которого с а,Р-непредельными карбонильными производными по схеме реакции Михаэля должно приводить к требуемому результату. Было также очевидно, что главная проблема в таком подходе связана с крайней нестабильностью 298а,что исключало возможность применения каких-либо из обычных методов генерации ионных интермеди-атов. Однако эту проблему удалось решить благодаря использованию в качестве катализаторов этой реакции комплексов Pd(O), для которых была известна способность образовывать комплексы с различными лигандами аллиль-ного типа. Действительно, было найдено, что в присутствии таких комплексов можно проводить реакции 298 с самыми различными акцепторами Михаэля по схеме, показанной на примере синтеза297 [29i].
В заключении этого раздела нельзя не сказать о том, что легкость образования пяти- и шесгичленных циклических структур особенно наглядно проявляется на примерах синтеза гетероциклических систем, где ключевой стадией является создание связи углерод-гетероатом. Набор некоторых примеров такого рода превращений приведен на схеме 2.112.
Образование малеинового ангидрида (299)или валеролактона (300) может протекать самопроизвольно при умеренном нагревании или в еще более мягких условиях в присутствии следов минеральной кислоты. Особенно легко проходит образование пяти- и шестичленных полуацеталей из соответствующих гидроксикарбонильных соединений. Так, в водном растворе ациклическая форма глюкозы 301присутствует в исчезающе малом количестве, а основными изомерами в равновесии являются циклические формы 301Ьи 301а,с преобладанием последней. На самом деле производные моносахаридов могут существовать в ациклической форме, только если защитить альдегидную группу или гидроксильные группы в положениях 4 и 5.
Образование тетрагидрофуранового производного 302из соответствующего 1,4-диола — реакция, легко протекающая под действием кислого катализатора и практически не осложненная образованием олигомеров. Последнее осложнение практически неизбежно, если попытаться в этих же условиях превратить 1,6-диол в соответствующий семичленный гетероцикл.
На примерах синтезов пиразола 303и изоксазола 304показан хорошо известный и общий метод синтеза различных гетероциклов на основе легко получаемых производных пентандиона-1,3. Огромное множество гетероцикличсских производных самой различной структуры получают на основе сходных по типу методов, включающих реакции различных полифункциональных карбонильных соединений с гетероатомными нуклеофилами.
 Схема 2.112
Схема 2.112
|
Здесь уместно также вспомнить о защите карбонильных соединений или диолов путем образования циклических ацеталей или кеталей. Как мы уже видели, эти реакции протекают в очень мягких условиях и строго селективно, что объясняется именно выгодностью образования пяти- или шести-членных циклических производных.
Дата добавления: 2015-04-05; просмотров: 2455;
