Варьирование природы реагентов как способ управления селективностью реакции
Хорошо известно, что даже в пределах одной и той же реакции относительная реакционная способность родственных функций может ощутимо зависеть от конкретных особенностей используемого реагента. Поэтому правильный выбор реагента из уже имеющегося набора (или рациональный дизайн нового реагента) может оказаться наиболее эффективным путем обеспечения требуемой селективности данного превращения. Вот характерный пример.
В конце 1940-х годов в практику органической химии был внедрен принципиально новый и мощный восстановитель — алюмогидрид лития. Отвлекаясь от деталей механизма восстановления функциональных групп с помощью этого реагента, мы можем принять, что суть реакции состоит в нук-леофильной атаке гидрид-иона Н- на субстрат. Понятно, что субстратом по отношению к такому реагенту должен быть электрофил, и в принципе любые соединения, содержащие электрофильные группы, должны поддаваться восстановлению алюмогидридом лития. Если обратиться к схематической модели полифункционального субстрата 156 (схема 2.73), то можно ожидать, что все три показанные функциональные группы будут способны восстанавливаться этим реагентом. Однако известно, что эти группы достаточно заметно отличаются по реакционной способности и могут быть расположены в следующий ряд по мере уменьшения электрофильности: СНО > СООМе > СН2С1. Это проявляется, в частности, в том, что легко и быстро протекают реакции алюмогидрида лития с альдегидной и сложноэфирной функциями, но не с первичными хлоридами. Поэтому получение хлордиола 157 — тривиальная задача.
В то же время селективное восстановление альдегидной группы в 156 осуществить с помощью того же реагента не удастся, так как будет протекать также восстановление сложноэфирной группы, ибо скорости этих двух реакций, хотя и различимы, но вполне сопоставимы. Если бы алюмогидрид был единственным доступным источником гидрид-иона, то эффективное общее решение этой задачи найти было бы трудно. Однако существует широкий набор гидридных восстановителей, аналогичных по типу алюмогидриду, но значительно отличающихся от него как по активности, так и по другим характеристикам [23а]. Один из них — это боргидрид натрия. Связь В-Н в этом соединении несколько прочнее связи Аl-Н, и этот реагент является более слабым нуклеофилом по сравнению с алюмогидридом. Благодаря этому различия в скоростях реакций боргидрида с альдегидной и сложноэфирной группами являются препаративно значимыми, и поэтому с помощью бор-гидрида восстановление альдегидной группы в полифункциональной системе типа 156 вполне может быть осуществлено хемоспецифично с исключительным образованием продукта 158.
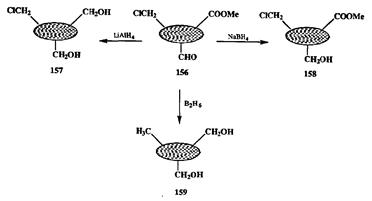 Схема 2.73
Схема 2.73
|
Наконец, если задача состоит в исчерпывающем восстановлении субстра-татипа 156, то можно воспользоваться еще одним, на этот раз более мощным донором гидрид-иона. Речь идет диборане В2Н6, о котором мы уже упоминали в связи с гидроборированием. Диборан успешно атакует (в несколько более жестких условиях) даже относительно слабые электрофилы типа хлорме-тепьной группы в 156, и с его помощью этот субстрат может быть превращен в диол 159. Еще более эффективно подобное исчерпывающее восстановление- может быть проведено с помощью так называемого супергидрида LiEt3BH, являющегося одним из самых мощных нуклеофилов [191]. Парадоксально, но и обратная задача селективности, а именно восстановление самой слабой по электрофильности хлорметильной группы в присутствии альдегидной или сложноэфирной, также может быть решена за счет выбора Подходящего гидридного восстановителя, которым на этот раз оказался цианоборгидрид натрия NaBH3CN [23b].
Методы восстановления комплексными гидридами с использованием самых разнообразных (но в принципе однотипных!) реагентов разработаны сейчас настолько хорошо, что задачу хемоселективного восстановления жить одной из групп возможно решить при почти любой комбинации восстанавливаемых функций в субстрате. Так, например, хорошо известна способность а,Р-непредельных альдегидов и кетонов в реакциях с восстановителями самых различных типов (например, боргидридом натрия) образовывать смеси продуктов как 1,2-, так и 1,4-присоединения. Однако модификацией природы гидридного восстановителя можно обеспечить любую хемоселективность при проведении этой реакции. Так, чистое 1,2-вос-СТановление может быть проведено с использованием системы NaBRj/CeCb [23c| или Zn(BH4)2 [23d] (схема 2.74). Интересно, что с помощью последнего реагента удается также провести селективное восстановление изолированной кетогруппы в присутствии сопряженной еноновой системы [23е].
Сравнительно недавно арсенал сингетиков обогатился за счет появления нового семейства гидридных восстановителей, литийаминоборанов LiABH3 (А — циклический амин) [23f]- Эти реагенты оказались исключительно активными и селективными в 1,2-восстановлении сопряженных альдегидов и кетонов, а их дополнительным преимуществом, выгодно отличающим их от самого алюмогидрида лития, является малая чувствительность к влаге.
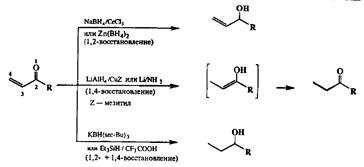 Схема 2.74
Схема 2.74
|
Если же синтетическая задача требует, напротив, селективного 1,4-воста-новления еноновой системы, то в качестве реагента для проведения этого превращения может использоваться алюмогидрид лития в присутствии комплексов меди [23g] или такой кчассический восстановитель, как литий в жидком аммиаке [23h]. Наконец, исчерпывающее восстановление еноново-го фрагмента может быть осуществлено с помощью мощного гидридного восстановителя КВН(втoр-Вu)3 или, в некоторых случаях, в условиях ионного гидрирования [23j].
На примере восстановления комплексными гидридами удобно показать также возможности управления и другим важнейшим параметром селективности, а именно стереоселекгивностью восстановления. Как мы уже упоминали в начале этой главы, восстановление 4-трет-бутилциклогексанона (160)может приводить к образованию смеси двух изомерных спиртов, 161 и 162 (схема 2.69). Если в качестве реагента для восстановления использовать NaBH4, то основным продуктом является термодинамически более стабильный транс-изомер 161 (схема 2.75). Если, однако, проводить восстановление с помощью гидридного реагента, содержащего объемистые группы, как, например, 1лВН(«яор-Ви)з, то селективность реакции меняется на обратную и основным продуктом оказывается г<мс-изомер 162[23i]. Наблюдаемая зависимость, как полагают, обусловлена тем, что наличие в субстрате 160 двух аксиальных водородов при С-3 и С-5 эффективно блокирует подход объемистого реагента LiBH(втор-Ви)3к карбонильной группе «сверху» от плоскости цикла, но в существенно меньшей степени препятствует такому направлению атаки для реагента меньшего размера, каким является NaBH4- Парадоксально, но уже упоминавшавшиеся выше литийаминобораны ведут себя как стерически незатрудненные реагенты и независимо от размера аминной группы дают практически индивидуальный (99%) транс-изомер 161 [23f].
Подобный описанному принцип «дозированного воздействия» — применения однотипных, но различных по определенным характеристикам реа-гентов для обеспечения требуемого характера селективности — широко используется в современном органическом синтезе. Более того, можно утверждать, что без наличия подобного многообразия синтетических инструментов, искусно настроенных на решение той или иной из конкретных задач селективности, вообще невозможно было бы осуществление очень многих из современных полных синтезов.
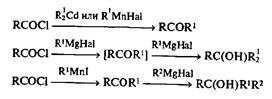
Не менее важно наличие широкого набора реагентов для тех или иных гетеролитических реакций образования связи С-С. В этой области, пожалуй, наибольшее разнообразие характерно для нуклеофильных реагентов. Так,известны десятки типов металлоорганических реагентов, которые содержат один и тот же органический остаток и различаются лишь природой металла и связанных с ним лигандов [4]. Подобные, в сущности очень сходные реагенты, разработанные для сочетания одного и того же нуклеофиль-Иого остатка с электрофильными реагентами, на самом деле могут значительно различаться по своей нуклеофильности, основности, способности к комплексообразованию и т. д. Благодаря этому можно решительным образом влиять на селективность реакций образования связи С-С в применении к взаимодействию как с электрофильными субстратами разных типов, так и с полидентатными электрофилами. Так, взаимодействие классических реагентов Гриньяра со сложными эфирами или хлорангидридами не может быть остановлено на стадии образования кетона, и продуктами такой реакции неизменно являются третичные спирты. В то же время замена магниевых производных на производные кадмия [24а] или марганца [24Ь] делает реакцию с хлорангидридами удобным методом синтеза несимметричных кстонов. На основе последовательности реакций хлорангидридов, первоначально с марганецорганическими производными, а затем с магнийорганическими реагентами, удалось разработать простой способ получения несимметричных третичных спиртов по схеме сборки из трех предшественников в одном реакционном сосуде [24с].
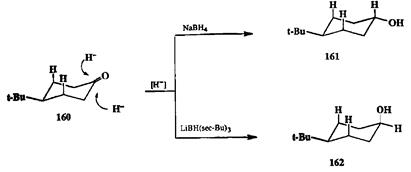 Схема 2.75
Схема 2.75
|
Особое место среди всего многообразия классов и типов металлоорганических реагентов принадлежит медьорганическим производным. Хотя мы уже неоднократна упоминали об их использовании в роли синтетических эквивалентов карбанионов в таких реакциях образования связи С—С, как сочетание по Вюрцу или присоединение по Михаэлю, здесь уместно несколько более подробно рассмотреть специфику использования этих реагентов, но на этот раз с точки зрения селективности превращений, обеспечиваемых их участием в некоторых реакциях образования связи С-С.
Медьорганические соединения типа RCu, как таковые, не очень часто применяются в синтетически значимых превращениях за исключением некоторых специфических случаев синтеза ацетиленовых соединений. Напротив, смешанные купраты переменного состава от R2CuLi до R3Cu2Li [24d|, a также их всевозможные комплексы с лигандами, такими, как Me:S, Ph3P, RS~, CN~ и т. д. [15с,d], находят самое разнообразное применение. К этому же типу реагентов относятся и магаийорганические реагенты, модифицированные добавками солей меди и лигандов, например, RMgBr/CuBr/Me2S.
Интересно хотя бы гасратце познакомиться с историей разработки куп-ратных реагентов. Первое медьорганическое производное, димегилмедь (Ме2Си), было получено Гилманом в 1936 г. [24е]. Целью этой работы являлось просто расширение круга известных в то время металлоорганических соединений и изучение их свойств вне какой-либо связи с общими проблемами органического синтеза. Несколько позднее (в 1941 г.) довольно случайно было обнаружено, что реакционная способность классических реагентов Гриньяра может изменяться в присутствии неорганических солей, в частности солей меди. Долгое время эти результаты казались частностями и поэтому не привлекали особого внимания. Однако ситуация изменилась решительным образом в 1960-х годах, когда в связи с задачей синтеза феромонов и простаноидов возникла острая необходимость в разработке общих и препаративно приемлемых методов управления селективностью реакций карбани-онных нуклеофилов с полифункциональными электрофилами. В связи с эгим вновь возник интерес к медьорганическим соединениям, и вскоре была показана перспективность использования реагентов на их основе для решение многих проблем селективности.
Так, в работах Хауса было найдено, что диметиллитийкупрат (Me2LiCu), реагент, полученный впервые еще в 1952 г. в лаборатории Гилмана, проявляет уникальную способность реагировать с а,р-непредельными альдегидами и кетонами с исключительным образованием продуктов сопряженного 1,4-присоединения [24f,g]. Аналогичным образом реагировали и другие алхил-литийкупраты [24h]. Эти результаты послужили мощным стимулом для последующих интенсивных исследований ряда групп, результатом которых явилась создание обширного нового класса нуклеофилов — купратных реагентов, эквивалентов карбанионов различной структуры. Уместно отметить, что все эти реагенты легко могут быть получены из обычных литий- или магнийорганических соединений путем добавления требуемого количества солей меди и модифицирующих добавок.
Благодаря этим разработкам впервые удалось создать надежный и общий метод 1,4-присоединения С-нуклеофилов по двойной связи о,(3-непредель-ных карбонильных соединений (о стратегической важности этого метода, см. выше разд. 2.2.3.3, а также разд. 3.2.7) [15с]. К эгому следует добавить, что если модифицировать те же самые реагенты Гриньяра, но не солями меди, а солями церия (церийорганические реагенты), то с этими же субстратами можно столь же чисто провести исключительное 1,2-присоединение. Таким образом, за счет модификации исходного металлоорганичееского реагента тем или иным из упомянутых способов удается эффективно управлять селективностью присоединения С-нуклеофилов по одному из двух электрофиль-ных центров, имеющихся в молекуле исходного сопряженного карбонильного соединения [4, 15b-d] (схема 2.76).
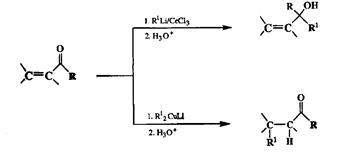 Схема 2.76
Схема 2.76
|
О том, как с помощью все тех же купратных реагентов стало возможным проводить селективное сочетание по схеме реакции Вюрца, мы уже говорили выше (см. разд. 2.2.3.1). В этой связи необходимо также сказать еще о таких синтетически значимых особенностях свойств купратов, как их сравнительная инертность по отношению к карбонильным электрофилам и, напротив, необычно высокая активность по отношению к таким слабым электрофилам, как винил- или арилгалогениды [24ij]. Эти особенности купратов позволяют использовать эти нуклеофилы как реагенты для селективного ал-килирования полифункциональных электрофилов различных типов, как это показано на модельных примерах на схеме 2.77.
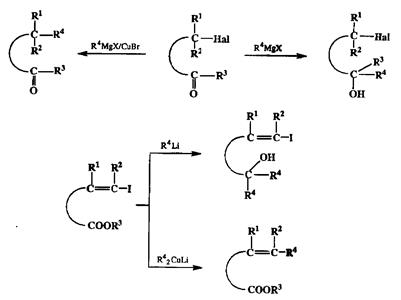 Схема 2.77
Схема 2.77
|
Тема вариабильности свойств нуклеофилов карбанионного типа в зависимости от природы металла получила интересное развитие в работах Кнохеля [24k]. Хорошо известно, что цинкорганические реагенты относятся к категории довольно малоактивных нуклеофилов. Исследованиями группы Кнохеля было показано, что активность этих реагентов существенно возрастает, если их модифицировать добавлением цианида меди. Авторы разработали метод, позволяющий превращать дииодалканы типа 163(схема 2.78) в гетеробиметаллические производные типа 163а. Наличие в последних двух достаточно различных по активности нуклеофильных центров позволило провести с высокой селективностью два последовательных сочетания с различными электрофильными реагентами, как это представлено на схеме 2.78. Синтетический интерес подобного тандема реакций представляется несомненным.
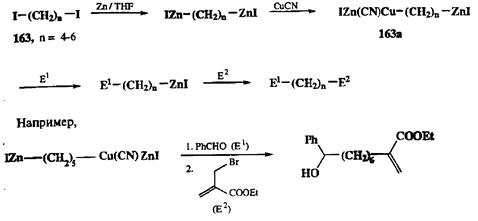 Схема 2.78
Схема 2.78
|
До сих пор мы рассматривали способы регулирования селективности образования связей С—С, основанные на изменениях в свойствах нуклеофиль-ной компоненты. Очевидно, что не менее эффективными средствами такого контроля могут быть вариации в природе реагентов, эквивалентных одному и тому же электрофилу. Например, столь различные по свойствам соединения, как RCO+BF4-, RCOCl, (RCO)2O, RCOOR1, в реакциях с нуклеофила-ми выступают в роли переносчиков одного и того же ацил-катиона. Точно также такие непохожие соединения, как соли триалкилоксония R3O+BF4-, алкилтозилаты, алкилгалогениды или алкилацетаты, могут использоваться в качестве эквивалентов одного и того же алкил-катиона. Понятно, что при наличии столь богатого арсенала электрофильных реагентов, различающихся по своей активности, стабильности, чувствительности к стерическим пре-пятствиям, эффектам растворителя и т. п., почти всегда можно выбрать такой реагент, который обеспечит нужную хемо- или региоселективность реакции с субстратом, имеющим несколько нуклеофильных центров.
Весьма поучительным примером того, насколько может быть эффективной регулировка селективности за счет казалось бы не очень значительных вариаций в природе электрофильной и/или нуклеофильной компонент, мо-жет служить результаты исследований группы Котсуки [241], направленных наразработку общей методологии синтеза ряда структурно различных энан-тиомерно чистых феромонов (см. схему 2.79).
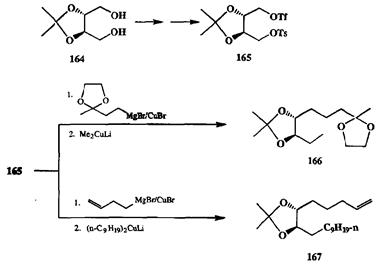 Схема 2.79
Схема 2.79
|
Замысел работы заключался в разработке способа использования легко доступного в энантиомерно чистом виде 2,3-О-изопропилиден-D-трент 164в качестве предшественника бифункционального электрофила, который да-леепредполагалось вводить в реакции последовательного контролируемого сочетания с набором нуклеофилов. Для достижения этой цели 164был превращен в смешанный тозилат-трифлат 165,что обеспечило создание двух электрофильных центров, различающихся по своей активности. Далее требовалось найти нуклеофилъные реагенты, способные селективно реагировать по одному из этих элсктрофильных центров. Оказалось, что стандартные диалкиллитийкупратные реагенты «не чувствуют» различия в активности тозилатной и трифлатной групп, и оба этих центра подвергались нуклео-фильнай атаке примерно с одинаковой легкостью. Напротив, менее активные реагенты алкилмагнийкупратного типа не реагировали с тозилатной функцией и замещению подвергалась исключительно трифлатная группа. Получающийся на первой стадии продукты далее повторно алкилировали, на этот раз по оставшейся тозилатной группе, с помощью диалкиллитий-купратных реагентов. Примечательно, что обе стадии алкилирования проводятся как последовательность реакций в одном реакционном сосуде и приводят к образованию целевых продуктов с высоким выходом. Разработанная схема несимметричного бис-алкилирования допускает возможность независимого варьирования строения нуклеофильного остатка в реагентах, используемых на первой и второй стадиях последовательности (см., например, получение аддуктов 166и 167,схема 2.79). Таким образом, на основе общего хирального бифункционального субстрата 165можно получать широкий набор разнообразных продуктов, которые далее могут использоваться как субстраты в синтезе энантимерно чистых целевых соединений, в том числе и ряда феромонов. Отметим еще раз, что успешное решение подобного рода непростых задач стало достижимым только благодаря наличию широких возможностей тонко дозируемых изменений свойств применяемых реагентов.
Дата добавления: 2015-04-05; просмотров: 1829;
