Реальные газы.
При низких температурах или больших давлениях при описании свойств газов необходимо учитывать характер молекулярных взаимодействий.
Молекулярные взаимодействия. Между молекулами реальных газов существуют силы взаимодействия, характер и величина которых определяются индивидуальными свойствами, строением молекул и значениями основных параметров – давления и температуры. Значения этих сил определяют внутреннюю потенциальную энергию молекул реального газа. При больших давлениях и плотностях свойства газов зависят от размеров самих молекул. Молекулы не имеют определенных (жестких) размеров; размеры атомов и молекул могут изменяться в некоторых пределах. Электронные оболочки атомов непрерывно колеблются относительно ядра даже при нулевой термодинамической температуре. Колебания электронных оболочек обусловливают появление электрических полей и объясняют механизм возникновения сил притяжения Ван-дер-Ваальса. В молекулах валентные электроны находятся на более низких энергетических уровнях, чем в атомах; разность уровней обусловливает величину энергии диссоциации. Если молекулы (или атомы) сближены на такое расстояние, что их электронные оболочки начинают сильно проникать одна в другую, то возникает отталкивающая сила, быстро увеличивающаяся с уменьшением расстояния и, наконец, превосходящая силу притяжения.
Сжимаемость. Объемы единицы массы реального и идеального газов различаются при одинаковых давлении и температуре в основном из-за наличия межмолекулярных сил.
Уравнения состояния. Простейшее по форме эмпирическое уравнение состояния реального газа, полученное по результатам исследования сжимаемости, имеет вид:
для 1 кг газа
pv=zRT,
для G кг газа
pV=zGRT
или в форме уравнения Менделеева–Клапейрона
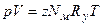 ;
; 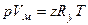 ; pV=zGRyT/M.
; pV=zGRyT/M.
Безразмерный коэффициент
z=pv/(RT)
называется коэффициентом сжимаемости.
Для определения z используют специальные таблицы.
Вириальная форма уравнения состояния для представления экспериментальных данных без раскрытия механизма, управляющего поведением молекул, впервые предложена в 1901 г. Камерлинг-Оннесом:
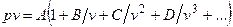 ,
,
где А, В, С, D,… – вириальные коэффициенты.
Вириальные коэффициенты являются функциями температуры и свойств газов, т.е. для каждой изотермы значения В, С, D,… различны.
Обычно вириальные коэффициенты записывают в виде полиномов: 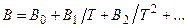 .
.
Эмпирические уравнения состояния, записанные в вириальной форме, в настоящее время наиболее употребимы, хотя не раскрывают механизм, управляющий поведением молекул реального газа.
Дата добавления: 2015-05-16; просмотров: 1010;
