Идеальное газовое состояние.
Все законы идеальных газов установлены на основании результатов экспериментов с реальными газами при малых давлениях. В связи с этим эмпирически установленному понятию идеального газового состояния (идеального газа) соответствует такой газ, свойства которого в первом приближении идентичны свойствам реального газа при низких давлениях. С точки зрения молекулярно-кинетических представлений модель идеального газа является совокупностью молекул, движущихся во всех направлениях. Все направления движения равновероятны. Размеры молекул ничтожно малы по сравнению с расстояниями между ними. Силы взаимодействия между молекулами отсутствуют. Молекулы взаимодействуют одна с другой и стенками сосуда только при взаимных столкновениях, причем характер этих столкновений является идеально упругим.
Уравнения состояния. В идеальном состоянии газ подчиняется уравнению состояния Бойля–Гей-Люссака; соответственно для 1 кг и G кг газа
pv=RT и pV=GRT.
Известна также другая форма уравнения состояния идеального газа – уравнение Менделеева–Клапейрона:
pV=GRyT/M,
где M – масса одного киломоля.
Кроме того, уравнение состояния идеального газа можно записать в виде
pV=nkT,
где n – число молекул в объеме V; k – постоянная Больцмана.
Для всех газов
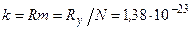 Дж/К;
Дж/К;
здесь m – масса одной молекулы; N – число молекул в одном киломоле.
При одинаковых давлении и температуре объем одного киломоля любого газа в идеальном состоянии одинаков. При нормальных условиях он равен примерно 22,4 м3.
Зная уравнения состояния и используя фундаментальные соотношения термодинамики, можно определить основные тепловые свойства идеального газа.
Дата добавления: 2015-05-16; просмотров: 1434;
