Особенности ферментативного катализа. 3 страница
роль в биосинтезе белков и нуклеиновых кислот, поэтому становятся
понятными те глубокие нарушения обмена, которые наблюдаются при
недостаточности фолиевой кислоты.
В медицинской практике (в частности, в онкологии) нашли применение
некоторые синтетические аналоги (антагонисты) фолиевой кислоты. Так,
4-аминоптерин используется в качестве препарата, тормозящего синтез
нуклеиновых кислот, и рекомендуется в качестве лечебного препарата при
опухолевых поражениях, в частности при острых и хронических формах
лейкозов у детей и взрослых.
24.Биотин.
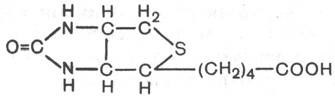
Витамин Н,кофермент карбоксилирования.
Биотин подробно изучен благодаря работам
Ф. Линена. Известные к настоящему времени биотиновые ферменты (т.е.
ферменты, содержащие в качестве кофермента биотин) катализируют два
типа реакций:
1) реакции карбоксилирования (с участием СО2 или НСО3
–), сопря-
женные с распадом АТФ
RH + HCO3
– + АТФ <=> R-COOH + АДФ + Н3РО4;
2) реакции транскарбоксилирования (протекающие без участия АТФ),
при которых субстраты обмениваются карбоксильной группой
R1-COOH + R2H <=> R1H + R2-COOH.
Получены доказательства двустадийного механизма этих реакций с
образованием промежуточного комплекса (карбоксибиотинилфермент).
К реакциям первого типа относятся, например, ацетил-КоА- и пируват-
карбоксилазные реакции:
CH3–CO–S-KoA + CO2 + АТФ <=> HOOC–CH2–CO–KoA + АДФ + Pi.
Пируваткарбоксилаза является высокоспецифичным ферментом, ката-
лизирующим уникальную реакцию усвоения СО2 в организме животных.
Сущность реакции сводится к пополнению запасов оксалоацетата (щаве-
левоуксусная кислота) в лимоннокислом цикле (так называемые «анаплеро-
тические», «пополняющие» реакции), т.е. его синтезу из СО2 и пирувата:
Пируват + CO2 + АТФ + H2O —> Оксалоацетат + АДФ + Pi + 2H+
Реакция протекает в две стадии: на первой стадии, связанной с затратой
энергии, СО2 подвергается активированию, т.е. ковалентному связыванию
с биотином в активном центре фермента (Е-биотин):
CO2 + Биотин + АТФ + H2O Биотин + АДФ + Pi + 2H+
На второй стадии СО2 из комплекса переносится на пируват с об-
разованием оксалоацетата и освобождением фермента:
Примером второго типа реакций является метилмалонил-оксалоаце-
тат-транскарбоксилазная реакция, катализирующая обратимое превраще-
ние пировиноградной и щавелевоуксусной кислот:
Реакции карбоксилирования и транскарбоксилирования имеют важное
значение в организме при синтезе высших жирных кислот, белков, пури-
новых нуклеотидов (соответственно нуклеиновых кислот) и др.
25. Активный центр ферментов
При изучении механизма химической реакции, катализируемой фермента-
ми, исследователя всегда интересует не только определение промежуточных
и конечных продуктов и выяснение отдельных стадий реакции, но и природа
тех функциональных групп в молекуле фермента, которые обеспечивают
специфичность действия фермента на данный субстрат (субстраты) и высо-
кую каталитическую активность. Речь идет, следовательно, о точном
знании геометрии и третичной структуры фермента, а также химической
природы того участка (участков) молекулы фермента, который обеспе-
чивает высокую скорость каталитической реакции. Участвующие в фер-
ментативных реакциях молекулы субстратов часто имеют небольшие раз-
меры по сравнению с молекулами ферментов, поэтому было высказано
предположение, что при образовании фермент-субстратных комплексов
в непосредственный контакт с молекулой субстрата, очевидно, вступает
ограниченная часть аминокислот пептидной цепи. Отсюда возникло пред-
ставление об активном центре фермента. Под активным центром
подразумевают уникальную комбинацию аминокислотных остатков в мо-
лекуле фермента, обеспечивающую непосредственное связывание ее с мо-
лекулой субстрата и прямое участие в акте катализа (рис. 4.2). Установлено,
что у сложных ферментов в состав активного центра входят также просте-
тические группы.
В активном центре условно различают так называемый каталити-
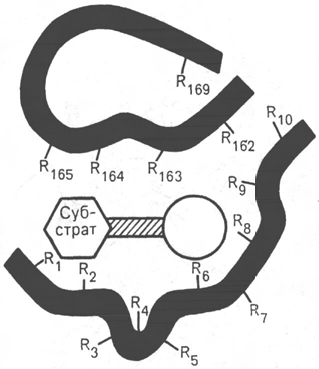
Рис. 4.2. Активный центр фер-
мента (схема) (по Малеру и
Кордесу).
Темные полосы - участки полипеп-
тидной цепи фермента; R - амино-
кислотные остатки и их порядковые
номера (с N-конца).
ческий центр, непосредственно вступающий в химическое взаимодейст-
вие с субстратом, и связывающий центр, или контактную («якор-
ную») площадку, которая обеспечивает специфическое сродство к субст-
рату и формирование его комплекса с ферментом. В свою очередь молекула
субстрата также содержит функционально различные участки: например,
субстраты эстераз или протеиназ – одну специфическую связь (или группу
атомов), подвергающуюся атаке со стороны фермента, и один или несколь-
ко участков, избирательно связываемых ферментом.
Получены экспериментальные доказательства наличия в активном цент-
ре химотрипсина двух остатков гистидина и остатка серина, схематически
представленных в трехмерной структурной модели предшественника этого
фермента (рис. 4.3). Выявление химической природы и вероятной топогра-
фии групп активного центра – проблема первостепенной важности. Она
сводится к определению природы аминокислот, их последовательности
и взаиморасположения в активном центре. Для идентификации так назы-
ваемых существенных аминокислотных остатков используют специфиче-
ские ингибиторы ферментов (часто это субстратподобные вещества или
аналоги коферментов), методы «мягкого» (ограниченного) гидролиза в со-
четании с химической модификацией, включающей избирательное окисле-
ние, связывание, замещение остатков аминокислот и др.
При помощи методов ингибиторного анализа были предприняты по-
пытки установить закономерности состава и структуры активных центров
у ферментов, относящихся к разным группам. В частности, при использо-

Связывающий центр,активный центр
Активный центр
Молекула химотрипсина
вании диизопропилфторфосфата (ДФФ), принадлежащего к так называе-
мым нервным ядам, наблюдается полное выключение активного центра
холинэстеразы – фермента, катализирующего гидролиз ацетилхолина на
холин и уксусную кислоту. Оказалось, что этот ингибитор имеет близкое
структурное сходство с ацетилхолином и подобно ему взаимодействует
с ОН-группой остатка серина в активном центре. Вызывая фосфори-
лирование серина в активном центре ряда других ферментов, ДФФ также
инактивирует их действие:
Показано, что ДФФ избирательно фосфорилирует в каждом чувстви-
тельном к нему ферменте только один остаток серина, наделенный
функциональной активностью. Учитывая этот механизм действия ДФФ,
сделаны попытки определения природы аминокислот в окружении «ка-
талитического» остатка серина у ряда ферментов (табл. 4.2).
Из данных табл. 4.2 видно, что ферменты, сходные по типу действия,
хотя и различаются специфичностью, могут иметь почти одинаковую
последовательность аминокислотных остатков в тех участках, которые
примыкают к остатку серина, несущему функционально активную гидро-
ксильную группу. Существенное значение ОН-группы серина для акта
катализа было доказано, кроме того, химическим ее блокированием или
удалением, когда эстеразы полностью лишались ферментативной актив-
ности.
Активный фермент ДФФ Неактивный фермент
Фермент
Химотрипсин
Трипсин
Тромбин
Эластаза
Бутирилхолинэстераза
Ацетилхолинэстераза
Алиэстераза печени
Щелочная фосфатаза (E. coli)
Субтилизин (В. subtilis)
Протеаза (Aspergillius orizae)
Фосфоглюкомутаза
Фосфорилаза
Последовательность остатков
аминокислот вокруг серина
—Гли—Асп—Сер—Гли—Гли—
—Гли—Асп—Сер—Гли—Про—Вал—
—Асп—Сер—Гли—
—Асп—Сер—Гли—
—Гли—Глу—Сер—Ала—
—Глу—Сер—Ала—
—Гли—Глу—Сер—Ала—Гли—Гли—
—Тре—Асп—Сер—Ала—Сер—Ала—
—Гли—Тре—Сер—Мет—Ала—
—Тре—Сер—Мет—Ала—
—Тре—Ала—Сер—Гис—Асп—
—Глн—Иле—Сер—Вал—Apг—
Предполагают, что формирование активного центра фермента начи-
нается уже на ранних этапах синтеза белка-фермента (см. главу 14) на
рибосоме, когда линейная одномерная структура пептидной цепи превра-
щается в трехмерное тело строго определенной конфигурации. Образо-
вавшийся белок приобретает информацию совершенно нового типа, а
именно функциональную (в частности, каталитическую). Любые воздейст-
вия, приводящие к денатурации, т.е. нарушению третичной структуры,
приводят к искажению или разрушению структуры активного центра
и соответственно потере ферментом каталитических свойств. Если при
подходящих внешних условиях удается восстановить нативную трехмерную
структуру белка-фермента (ренатурировать его), то восстанавливается и его
каталитическая активность. Это было показано впервые на примере рибо-
нуклеазы поджелудочной железы
26.
РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
Влияние закона действия масс. В катализируемой ферментом обратимой
химической реакции, например А + В <=> С + D, концентрация компонентов
реакции и соответственно направление реакции будут регулироваться влия-
нием закона действия масс. Оно, в частности, может быть показано
в обратимой реакции трансаминирования, катализируемой ферментом
аланинаминотрансферазой:
Аланин + α-Кетоглутарат <=> Пируват + Глутамат.
Этот тип регуляции играет, очевидно, лишь ограниченную роль, по-
скольку в реальных условиях реакция обычно протекает в одном направле-
нии, так как образовавшиеся продукты могут оказаться субстратами для
действия других ферментов и выводиться из сферы реакции. В этих случаях
устанавливается скорее устойчивое (стационарное) состояние, чем истинное
равновесие.
Изменение количества фермента. На бактериях хорошо изучен феномен
индуцированного (индуцирующего) синтеза ферментов при выращи-
вании их на среде, где единственным источником углерода и энергии служит
тот или иной углевод, например глюкоза. Замена в среде глюкозы на
лактозу (индуктор) приводит к индуцированному или адаптивному (после
небольшого периода лаг-фазы) синтезу фермента галактозидазы (програм-
мированному лактозным геном, см. главу 13), расщепляющей лактозу на
глюкозу и галактозу.
В клетках прокариот и эукариот имеются ферменты, концентрация
которых не требует добавления индуктора; это так называемые консти-
тутивные ферменты. Количество фермента в клетке зависит от наличия
продукта реакции, катализируемой данным ферментом, причем продукт
реакции вызывает торможение синтеза фермента в результате репрессии
(В животных тканях быстрый синтез ферментов наблюдается реже.
Механизм его (индуцирующий синтез) изучен только для небольшого
числа ферментов: тирозинтрансаминазы, серин- и треониндегидратазы,
триптофанпирролазы и др. – в ответ на введение гормонов или прием
белковой пищи. Однако при поступлении в организм некоторых ядов,
канцерогенных веществ, алкалоидов, инсектицидов через несколько дней
наблюдается резкое повышение активности (соответственно количества)
ферментов-гидроксилаз (монооксигеназ) эндоплазматической сети
клеток печени, окисляющих чужеродные вещества в нетоксичные для
организма продукты. Вполне допустимо предположить, что в этих случаях
имеет место синтез ферментов путем индукции (т.е. de novo). Описаны
случаи, когда под действием подобных гидроксилаз чужеродные вещества
превращаются в организме в более токсичные соединения. Это явление,
обратное детоксикации, получило название летального синтеза.
Проферменты. Протеолитические ферменты пищеварительного тракта,
а также поджелудочной железы синтезируются в неактивной форме – в виде
проферментов (зимогенов). Регуляция в этих случаях сводится к пре-
вращению проферментов в активные ферменты под влиянием специфи-
ческих агентов или других ферментов – протеиназ. Так, трипсин в под-
желудочной железе синтезируется в форме неактивного трипсиногена.
Поступив в кишечник, он превращается в активный трипсин в результате
аутокатализа или под действием других протеиназ (механизм активации
подробно рассматривается в главе 12). Превращение неактивного пепси-
ногена в активный пепсин происходит аутокаталитически в результате
специфического ограниченного протеолиза в присутствии соляной кислоты
и также связано с отщеплением от профермента специфического ингибитора
пептидной природы. Эти превращения зимогенов в активные ферменты
связаны с конформационными изменениями молекулы фермента и форми-
рованием активного центра или его раскрытием (демаскирование). Синтез
протеиназ в неактивной форме и ряда других неактивных белков-пред-
шественников имеет, очевидно, определенный биологический смысл, пре-
дотвращая разрушение клеток органов, в которых образуются профер-
менты.
Химическая модификация фермента. Некоторые белки при формиро-
вании третичной структуры подвергаются постсинтетической химической
модификации Оказалось, что активность ряда ключевых
ферментов обмена углеводов, в частности фосфорилазы, гликогенсинтазы
и др., также контролируется путем фосфорилирования и дефосфорили-
рования, осуществляемого специфическими ферментами – протеинкиназой
и протеинфосфатазой, активность которых в свою очередь регулируется
гормонами .Уровень активности ключевых ферментов обмена
углеводов и соответственно интенсивность и направленность самих про-
цессов обмена определяются соотношением фосфорилированных и де-
фосфорилированных форм этих ферментов.
Обычно различают обратимую ковалентную и нековалентную хими-
ческие модификации ферментов, осуществляемые через ОН-группы серина,
реже – тирозина или за счет нековалентных взаимодействий с молекулой
фермента.
27.Аллостерическая регуляция. Во многих строго биосинтетических реак-
циях основным типом регуляции скорости многоступенчатого фермента-
тивного процесса является ингибирование по принципу обратной
связи. Это означает, что конечный продукт биосинтетической цепи подав-
ляет активность фермента, катализирующего первую стадию синтеза,
которая является ключевой для данной цепи реакции. Поскольку конечный
продукт структурно отличается от субстрата, он связывается с аллостери-
ческим (некаталитическим) центром молекулы фермента, вызывая ингиби-
рование всей цепи синтетической реакции.
Предположим, что в клетках осуществляется многоступенчатый био-
синтетический процесс, каждая стадия которого катализируется собст-
венным ферментом:
Скорость подобной суммарной последовательности реакций в значи-
тельной степени определяется концентрацией конечного продукта Р,
накопление которого выше допустимого уровня оказывает мощное инги-
бирующее действие на первую стадию процесса и соответственно на
фермент E1.
Впервые существование подобного механизма контроля активности
ферментов метаболитами было обнаружено у Е.coli при исследовании
синтеза изолейцина и ЦТФ. Оказалось, что изолейцин, являющийся
конечным продуктом синтеза, избирательно подавляет активность треонин-
дегидратазы, катализирующей первую стадию последовательного процесса
превращения треонина в изолейцин, насчитывающего пять ферментативных
реакций:
Аналогично ЦТФ как конечный продукт биосинтетического пути оказы-
вает ингибирующий эффект на первый фермент (аспартаткарбамоилтран-
сферазу), регулируя тем самым свой собственный синтез (см. главу 13).
Этот тип ингибирования получил название ингибирования по принципу
обратной связи, или ретроингибирования. Существование его доказано
во всех живых организмах. В настоящее время он рассматривается как один
из ведущих типов регуляции активности ферментов и клеточного мета-
болизма в целом *.
С другой стороны, в амфиболических процессах, выполняющих одно-
временно биосинтетические и биодеградативные функции **, доказано существование регуляции как по типу ретроингибирования, так и макроэрги-
ческими соединениями – индикаторами энергетического состояния клетки.
Для амфиболических процессов уникальным типом регуляции, свойствен-
ным только им, является, кроме того, активация предшественником,
когда первый метаболит в многоступенчатом пути активирует фермент,
катализирующий последнюю стадию. Так, доказано активирующее влияние
глюкозо-6-фосфата, являющегося предшественником гликогена, на фермент
гликогенсинтазу.
Подобные типы ингибирования конечным продуктом и активирования
первым продуктом свойственны аллостерическим (регуляторным) фермен-
там, когда эффектор, модулятор, структурно отличаясь от субстрата,
связывается в особом (аллостерическом) центре молекулы фермента, прост-
ранственно удаленном от активного центра. Следует, однако, иметь в виду,
что модуляторами аллостерических ферментов могут быть как активаторы,
так и ингибиторы. Часто оказывается, что сам субстрат оказывает активи-
рующий эффект. Ферменты, для которых и субстрат, и модулятор пред-
ставлены идентичными структурами, носят название гомотропных в от-
личие от гетеротропных ферментов, для которых модулятор имеет
отличную от субстрата структуру. Взаимопревращение активного и неак-
тивного аллостерических ферментов в упрощенной форме, а также конфор-
мационные изменения, наблюдаемые при присоединении субстрата и эф-
фекторов, представлены на рис. 4.25. Присоединение отрицательного эф-
фектора к аллостерическому центру вызывает значительные изменения
конфигурации активного центра молекулы фермента, в результате чего
фермент теряет сродство к своему субстрату (образование неактивного
комплекса).
Аллостерические взаимодействия проявляются в характере кривых за-
висимости начальной скорости реакции от концентрации субстрата или
эффектора, в частности в S-образности этих кривых (отклонение от гипер-
болической кривой Михаэлиса-Ментен). S-образный характер зависимости
v от [S] в присутствии модулятора обусловлен эффектом кооперативности.
Это означает, что связывание одной молекулы субстрата облегчает связы-
вание второй молекулы в активном центре, способствуя тем самым увели-
чению скорости реакции. Кроме того, для аллостерических регуляторных
ферментов характерна нелинейная зависимость скорости реакции от кон-
центрации субстрата.
28. Четвертичная структура аллостерических ферментов. Кооперативные изменения конформации протомеров при функционировании.
29. Фосфорилирование дефосфорилирование.
Протеинкиназы катализируют фосфорилирование белков по гидроксильным группам серина, треонина и тирозина. Если фосфорилируемые белки это тоже ферменты, то их активность в результате фосфорилирования в одних случаях уменьшается, в других — увеличивается. Например, в клетках жировой ткани есть липаза, существующая в двух формах — фосфопротеина и простого белка.
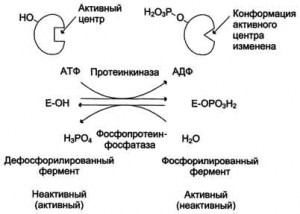
Регуляция ферментов.
Эти формы могут превращаться друг в друга. Фосфопротеин образуется в результате действия протеинкиназы и может вновь превращаться в простой белок при действии фосфопротеинфосфатазы — фермента, гидролитически отщепляющего фосфорную кислоту от фосфопротеинов Фосфорилированная липаза обладает значительно более высокой активностью, чем нефосфорилированная.
Протеинкиназы — это группа ферментов, различающихся специфичностью: разные протеинкиназы фосфорилируют разные белки. То же можно сказать и о проте-инфосфатазах. Такой механизм регулирует активность очень многих ферментов.Одним из важных примеров такой регуляции является регуляция протеинкиназы А. Протеинкиназа А в активной форме представляет собой белок, построенный из одной пептидной цепи (субъединица С, каталитическая). В клетке имеется другой белок (субъединица R, регуляторная), способный соединяться с белком С, причем образуется тетрамерный комплекс R2C2. Этот комплекс не обладает ферментативной активностью: субъединица R выступает в роли белка-модулятора — ингибирует фермент (субъединицу С). Активация фермента происходит при участии цик-лоаденозинмонофосфата (З'^'-цикло-АМФ, или цАМФ).На поверхности субъединицы R есть два центра связывания цАМФ; после присоединения цАМФ изменяется конформация белка, при этом сродство субъединиц R к субъединицам С уменьшается, и происходит диссоциация комплекса с образованием двух молекул активной протеинкиназы А (рис. 2.29). Этот процесс обратимый, его направление зависит от концентрации цАМФ в клетке: повышение концентрации ведет к активации протеинкиназы,
30. Участие ферментов в проведении гормонального сигнала в клетку (лекция).
31. Изоферменты, или изоэнзимы,– это множественные формы фермента, ка-
тализирующие одну и ту же реакцию, но отличающиеся друг от друга по
физическим и химическим свойствам, в частности по сродству к субстрату,
максимальной скорости катализируемой реакции (активности), электро-
форетической подвижности или регуляторным свойствам.
В живой природе имеются ферменты, молекулы которых состоят из двух
и более субъединиц, обладающих одинаковой или разной первичной,
вторичной или третичной структурой. Субъединицы нередко называют
протомерами, а объединенную олигомерную молекулу – мультимером
Считают, что процесс олигомеризации придает субъединицам белков
повышенную стабильность и устойчивость по отношению к действию
денатурирующих агентов, включая нагревание, влияние протеиназ и др.
Однако на нынешнем этапе знаний нельзя ответить однозначно на вопрос
о существенности четвертичной структуры для каталитической активности
ферментов, поскольку пока отсутствуют методы, позволяющие в «мягких»
условиях разрушить только лишь четвертичную структуру. Применяемые
обычно методы жесткой обработки (экстремальные значения рН, высокие
концентрации гуанидинхлорида или мочевины) приводят к разрушению не
только четвертичной структуры, но и вторичной и третичной структур
стабильного олигомерного фермента, протомеры которого оказываются
денатурированными и, как следствие этого, лишенными биологической
активности.
Следует указать на отсутствие ковалентных, главновалентных связей
между субъединицами. Связи в основном являются нековалентными,
поэтому такие ферменты довольно легко диссоциируют на протомеры.
Удивительной особенностью таких ферментов является зависимость актив-
ности всего комплекса от способа упаковки между собой отдельных
субъединиц. Если генетически различимые субъединицы могут сущест-
вовать более чем в одной форме, то соответственно и фермент, образо-
ванный из двух или нескольких типов субъединиц, сочетающихся в разных
количественных пропорциях, может существовать в нескольких сходных, но
не одинаковых формах. Подобные разновидности фермента получили
название изоферментов (изоэнзимов или, реже, изозимов). В частности,
если фермент состоит из 4 субъединиц двух разных типов – Н и М (сер-
дечный и мышечный), то активный фермент может представлять собой
одну из следующих комбинаций: НННН, НННМ, ННММ, НМММ,
ММММ, или Н4, Н3М, Н2М2, НМ3, М4, соответствующую изоферментам
ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. При этом синтез Н- и М-типов
осуществляется различными генами и в разных органах экспрессируется
по-разному.
В одних случаях субъединицы имеют почти идентичную структуру
и каждая содержит каталитически активный участок (например, β-галакто-
зидаза, состоящая из 4 субъединиц). В других случаях субъединицы ока-
зываются неидентичными. Примером последних может служить трипто-
фансинтаза, состоящая из 2 субъединиц, каждая из которых наделена
собственной (но не основной) энзиматической активностью, однако, только
будучи объединенными в макромолекулярную структуру, обе субъединицы
проявляют триптофансинтазную активность.
Термин «множественные формы фермента» применим к белкам, ка-
тализирующим одну и ту же реакцию и встречающимся в природе в орга-
низмах одного вида. Термин «изофермент» применим только к тем мно-
жественным формам ферментов, которые появляются вследствие гене-
тически обусловленных различий в первичной структуре белка (но не
к формам, образовавшимся в результате модификации одной первичной
последовательности).
Одним из наиболее изученных 4 ферментов, множественность форм
которого детально изучена методом гель-электрофореза, является ЛДГ,
катализирующая обратимое превращение пировиноградной кислоты в мо-
лочную. Пять изоферментов ЛДГ образуются из 4 субъединиц примерно
одинакового размера, но двух разных типов. Поскольку Н-протомеры несут
более выраженный отрицательный заряд при рН 7,0–9,0, чем М-про-
томеры, изофермент, состоящий из 4 субъединиц Н-типа (Н4), при электро-
форезе будет мигрировать с наибольшей скоростью в электрическом поле
к положительному электроду (аноду). С наименьшей скоростью будет
продвигаться к аноду изофермент М4, в то время как остальные изо-
ферменты будут занимать промежуточные позиции. Следует подчеркнуть,
что изоферменты ЛДГ, обладая почти одинаковой ферментативной актив-
ностью, различаются некоторыми физико-химическими свойствами: мо-
лекулярной массой, электрофоретической подвижностью, отношением к ак-тиваторам и ингибиторам и др., однако для каждой ткани в норме
характерно свое соотношение форм (изоферментный спектр) ЛДГ. Напри-
мер, в сердечной мышце преобладает Н4, т.е. ЛДГ1 , а в скелетных мышцах
и печени – М4 (ЛДГ5) (рис. 4.6). Эти обстоятельства широко используют
в клинической практике, поскольку изучение появления изоферментов ЛДГ
(и ряда других ферментов) в сыворотке крови может представлять интерес
для дифференциальной диагностики органических и функциональных по-
ражений органов и тканей. По изменению содержания изоферментов
в сыворотке крови можно судить как о топографии патологического
процесса, так и о степени поражения органа или ткани.
32. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ

Современные классификация и номенклатура ферментов были разработаны
Комиссией по ферментам Международного биохимического союза и ут-
верждены на V Международном биохимическом конгрессе в 1961 г.
в Москве *.
Необходимость систематики номенклатуры диктовалась прежде всего
стремительным ростом числа вновь открываемых ферментов, которым
разные исследователи присваивали названия по своему усмотрению. Более
того, одному и тому же ферменту часто давали два или несколько названий,
что вносило путаницу в номенклатуру. Некоторые названия ферментов
вообще не отражали тип катализируемой реакции, а при наименовании
фермента исходили из названия субстрата, на который действует фермент,
с добавлением окончания -аза: в частности, амилазы (ферменты, гидро-
лизирующие углеводы), липазы (действующие на липиды), протеиназы
(гидролизирующие белки) и т.д.
До 1961 г. не было и единой классификации ферментов. Трудности
заключались в том, что разные исследователи за основу классификации
ферментов брали различные принципы. Комиссией были рассмотрены
3 принципа, которые могли служить основой для классификации ферментов
Дата добавления: 2015-04-05; просмотров: 2052;
