Производство титана
Титан как элемент открыт в 1791 г. Его промышленное производство началось в 50-х годах XX века и получило быстрое развитие. Титановые сплавы имеют наиболее высокую удельную прочность среди всех металлических материалов, а также высокую жаропрочность и коррозионную стойкость и находят все более широкое применение в авиационной технике, химическом машиностроении и других областях техники. Титан используют для легирования сталей. Двуокись титана TiO2 используют для производства титановых белил и эмалей; карбид титана TiC — для особо твердых инструментальных сплавов.
Титан по распространению в природе занимает четвертое место среди металлов и входит в состав более чем 70 минералов. К основным промышленным титаносодержащим минералам относятся рутил (более 90% ТiO2) и ильменит TiO2-FeO (60%TiO2). Ильменит входит в состав титаномагнетитов — его смеси с магнитным железняком; они содержат до 20% ТiO2. К перспективным рудам относятся сфен CaO-SiO2-TiO2 (32—42% TiO 2) и перовскит СаО- TiO (60% ТiO 2).
Сырьем для получения титана являются титаномагнетитовые руды, из которых выделяют ильменитовый концентрат, содержащий 40 ... 45 % ТiO2, -30 % FеО, 20 % Fе2О3 и 5 ... 7 % пустой породы. Название этот концентрат получил по наличию в нем минерала ильменита FеО-ТiO2.
Ильменитовый концентрат плавят в смеси с древесным углем, антрацитом, где оксиды железа и титана восстанавливаются. Образующееся железо науглероживается, и получается чугун, а низшие оксиды титана переходят в шлак. Чугун и шлак — разливают отдельно в изложницы. Основной продукт этого процесса - титановый шлак - содержит 80 ... 90 % ТiO 2, 2 ... 5 % FеО и примеси SiO2, А12О3, СаО и др. Побочный продукт этого процесса - чугун — используют в металлургическом производстве.
Полученный титановый шлак подвергают хлорированию в специальных печах. В нижней части печи располагают угольную насадку, нагревающуюся при пропус-кании через нее электрического тока. В печь подают брикеты титанового шлака, а через фурмы внутрь печи - хлор. При температуре 800 ... 1250 °С в присутствии углерода образуется четыреххлористый титан, а также хлориды СаС12> МgС12 и др.:
ТiO2 + 2С + 2С12 = ТiСl + 2СО.
Четыреххлористый титан отделяется и очищается от остальных хлоридов благодаря различию температуры кипения этих хлоридов методом ректификации в специальиых установках.
Титан из четыреххлористого титана восстанавливают в реакторах при температуре 950 ... 1000 °С. В реактор загружают чушковый магний; после откачки воздуха и заполнения полости реактора аргоном внутрь его подают парообразный четыреххлористый титан. Между жидким магнием и четыреххлористым титаном происходит реакция
ТiС12 = Тi + 2МgС12.
Производство титана является технически сложным процессом. Двуокись титана TiO2 — химически прочное соединение. Металлический титан (tПЛ = 1725 °С), обладает большой активностью. Он бурно реагирует с азотом при температуре 500—600 °С и кислородом воздуха при 1200—1300 °С, поглощает водород, взаимодействует с углеродом и т. д. Наиболее широкое распространение получил магниетермический способ, осуществляемый по следующей технологической схеме: титановая руда ® обогащение ® плавка на титановый шлак ® получение четыреххлористого титана TiCl4 ® восстановление титана магнием.
Обогащение титановых руд. Титаномагнетиты и другие бедные руды обогащают электромагнитным и другими способами, получая концентрат, содержащий до 50 % TiO2 и около 35 % Fe2O3 и FeO.
Плавку на титановый шлак проводят в электродуговой печи. Шихтой служат прессованные брикеты, состоящие из мелкоизмельченного концентрата, антрацита или угля и связующего (сульфитный щелок). В результате плавки получают богатый титановый шлак, содержащий до 80 % TiO2. Побочным продуктом является чугун, содержащий до 0,5 % Ti. Измельченный шлак подвергают магнитной сепарации (для удаления железосодержащих частиц), смешивают с мелким нефтяным коксом и связующим и спрессовывают в брикеты. После обжига при 700—800 °С брикеты направляют на хлорирование.
Получение четыреххлористого титанаTiCl4 в герметизированных электрических печах представлено на рис. 2.9.

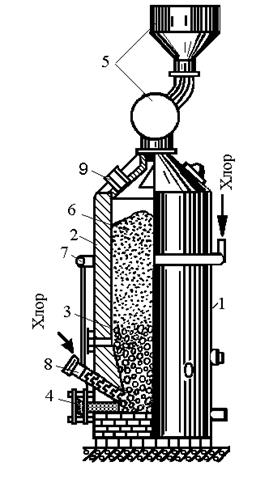
Нижнюю часть печи заполняют угольной (графитовой) насадкой, которая служит электрическим сопротивлением и нагревается при пропускании электрического тока. В реакционной зоне печи выше уровня угольной насадки развивается температура 800…850 °С. При хлорировании образуется четыреххлористый титан по реакции TiO2+2C-T2Cl2=TiCl4+2CO. Пары четыреххлористого титана находятся в паро-газовой смеси, содержащей SiCl4 и другие хлориды; СО, С12 и другие газы.
Ее очищают от твердых частиц и охлаждают в конденсаторах, в результате чего получают жидкий четыреххлористый титан. Для более полной очистки от твердых частиц конденсат отстаивают и фильтруют.
Четыреххлористый титан отделяют от других хлоридов путем ректификации конденсата, основанной на различии температур кипения различных хлоридов. Жидкий четыреххлористый титан направляют на восстановление.
В настоящее время для получения четыреххлористого титана начинают применять другие способы хлорирования: в хлоратоpax непрерывного действия, в солевом расплаве; перспективным является хлорирование в кипящем слое.
Восстановление титана магнием из TiCl4проводят в герметичных реакторах (ретортах) из нержавеющей стали, установленных в электрических печах сопротивления. После установки в печь из реторты откачивают воздух и заполняют ее очищенным аргоном; после нагрева до температуры 700° С заливают расплавленный магний и начинают подачу жидкого TiCl4. Титан восстанавливается магнием по реакции TiCl4+2Mg=Ti+2MgCl2. Эта реакция сопровождается выделением большого количества тепла и в реакторе поддерживается необходимая температура 800…900 °С без дополнительного нагрева за счет регулирования скорости подачи TiCl4. Частицы восстановленного титана спекаются в пористую массу (титановая губка), пропитанную магнием и хлористым магнием. Расплав хлористого магния периодически удаляют через патрубок в дне реактора. В промышленных реакторах (емкостью до 2 т) получают титановую губку, содержащую до 60% Ti, 30 °/o Mg и 10 % MgCl2.
Рафинирование титановой губкипроизводят методом вакуумной дистилляции. Крышку охладившейся реторты снимают и вместо нее устанавливают водоохлаждаемый конденсатор; затем реторту снова устанавливают в печь. Дистилляция проводится при 950…1000 °С и вакууме около 10-3 мм рт. ст. Примеси титановой губки Mg и MgCl2 расплавляются, частично испаряются и затем выделяются в конденсаторах. Получаемый оборотный магний возвращается в производство, MgCl2 используют для производства магния.
Получение титановых слитков. Титановые слитки получают переплавкой титановой губки в вакуумных электрических дуговых печах. Расходуемый электрод изготавливают прессованием из измельченной титановой губки. Электрическая дуга горит между расходуемым электродом и ванной расплавленного металла, постепенно заполняющего изложницу, затвердевающего и образующего слиток.
Наличие вакуума предохраняет металл от окисления и способствует его очистке от поглощенных газов и примесей.
Для получения слитков может быть использована дробленая титановая губка, загружаемая в печь дозатором. В этом случае дуга горит между расплавленным металлом и графитовым электродом, поднимаемым по мере заполнения изложницы металлом.
Для обеспечения высокого качества слитков плавку повторяют два раза. При второй плавке расходуемым электродом служит слиток, полученный при первой плавке.
Титановые сплавы выплавляют в электрических дуговых вакуумных печах, аналогичных применяемым для переплавки титановой губки. В качестве шихтовых материалов используют титановую губку и легирующие элементы в соответствии с заданным химическим составом сплава. Из шихты прессованием при 280….330 °С изготавливают переплавляемый (расходуемый) электрод. Плавку ведут в вакууме или в атмосфере аргона. Перед началом плавки на поддон в качестве затравки насыпают слой стружки из сплава такого же состава. Для более равномерного распределения легирующих элементов в сплаве полученный слиток переплавляют вторично.
Натриетермический способ получения титана отличается от магниетермического тем, что титан из TiCl4 восстанавливают металлическим натрием. Этот процесс проводят при относительно невысокой температуре, и титан в меньшей степени загрязняется примесями. Вместе с тем натриетермический способ технически более сложен.
Кальциееидридный способ основан на том, что при взаимодействии двуокиси титана TiO2 с гидридом кальция СаН2 образуется гидрид титана ТiH2, из которого затем выделяется металлический титан. Недостаток этого способа состоит в том, что получаемый титан сильно загрязнен примесями.
Иодидный способприменяют для получения небольших количеств титана очень высокой чистоты, до 99,99%. Он основан на реакции Ti+2I2 « TiI4, которая при 100 …200 °С идет слева направо (образование Til4), при 1300…1400 °С —в обратном направлении (разложение ТiI4).
Рафинируемую титановую губку помещают в реторту и нагревают до 100…200 °С; внутрь реторты вводят и разбивают ампулу с йодом, взаимодействующим с титаном по реакции Ti+2I2 ® TiI4. Разложение TiI4 ® Ti+2I2 и выделение титана происходит на титановых проволоках, натянутых в реторте, нагретых до 1300… 1400 °С пропусканием тока.
Дата добавления: 2015-04-25; просмотров: 1510;
