Производство алюминия
В группу легких металлов, имеющих плотность меньше 5 г/см, входят Al, Mg, Ti, Be, Ca, В, Zn, К и др. Наибольшее промышленное применение из них имеют алюминий, магний, титан.
Алюминий является самым распространенным металлом в земной коре. Он преимущественно встречается в виде соединений с кислородом и кремнием алюмосиликатов. Для получения алюминия используют руды, богатые глиноземом AI2O3. Чаще всего применяют бокситы, в которых содержится, %: Аl2О3 40—60, Fе2О3 15—30, SiO25—15, ТiO22—4 и гидратной влаги 10—15.
Технологический процесс производства алюминия состоит из трех этапов: извлечение глинозема из алюминиевых руд, электролиз расплавленного глинозема с получением первичного алюминия и его рафинирование. Извлечение глинозема обычно производят щелочным способом, применяемым в двух вариантах: мокром (метод Байера) и сухом.
При мокром методе бокситы сушат, измельчают и загружают в герметические автоклавы с концентрированной щелочью, где выдерживают в течение 2—3 ч при температуре 150…250 °С и давлении до 3 МПа. При этом протекают реакции взаимодействия гидрооксида алюминия с едким натром:
AI2O3 + ЗН2О + 2NaOH=Na2O•AI2O3 + 4Н2О.
Раствор алюмината натрия Nа2О•А12О в виде горячей пульпы идет на дальнейшую переработку. Оксиды железа, титана и другие примеси, не растворяющиеся в щелочах, выпадают в осадок-шлам.
Кремнезем также взаимодействует со щелочью и образует силикат натрия: SiO2 + 2NaOH = Na2O•SiO2 + 4Н2О, который, в свою очередь, взаимодействуя с алюминатом натрия, выпадает в осадок, образуя нерастворимое соединение Na2O· AI2O3 ·2SiO2·2Н2О.
Пульпа после фильтрации и разбавления водой сливается в отстойник, где из алюминатного раствора выпадает в осадок гидроксид алюминия:
Na2O· AI2O3 + 4Н2О = 2NaOH + 2A1 (ОН)3.
Гидроксид алюминия фильтруют и прокаливают при температуре до 1200 °С в трубчатых вращающихся печах. В результате получается глинозем:
2А1(ОН)3= AI2O3 + ЗН2О.
Сухой щелочной способ или способ спекания состоит в совместном прокаливании при температурах 1200…1300 °С смеси боксита, соды и извести, приводящем к образованию спека, в котором содержится водорастворимый алюминат натрия:
AI2O3 + Nа2СО3=Na2O · AI2O3 + СО2.
Известь расходуется на образование нерастворимого в воде силиката кальция СаО • SiO2. Алюминат натрия выщелачивают из спека горячей водой и полученный раствор продувают углекислотой:
Na2O AI2O3 + ЗН2О + СО2=2А1(ОН)3 +Nа2СО3.
Осадок промывают и прокаливают, получая глинозем, как и в предыдущем способе.
Алюминий получают электролизом глинозема, растворенного в расплавленном криолите Na3AlF6. Этот метод был предложен в 1886 г. одновременно Ч.Холлом в США и П.Эру во Франции и применяется до сих пор почти без изменений. Криолит получают в результате взаимодействия плавиковой кислоты HF с гидроксидом алюминия с последующей нейтрализацей содой:6HF + А1(ОН)3=Н3АlF6 + ЗН2О;
H3AIF6 + ЗNа2СО3=2Na3AlF6 + ЗН2О + СО2-
Электролиз осуществляют в алюминиевой ванне-электролизере, схема которого приведена на рис. 2.5.
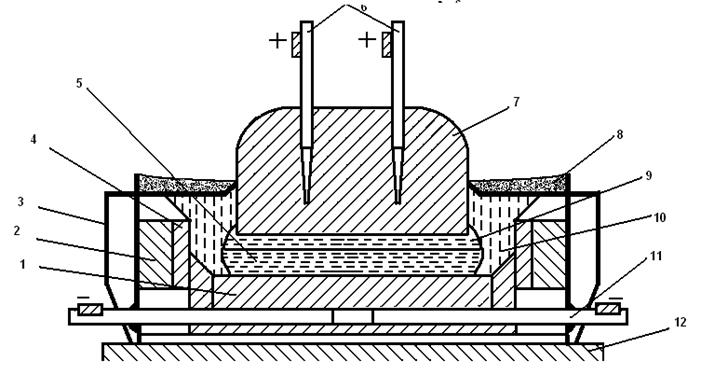
Рис. 2.5. Схема электролизера для производства алюминия:
1 — катодные угольные блоки; 2 — огнеупорная футеровка; 3 — стальной кожух; 4 — угольные плиты; 5 — жидкий алюминий; 6 — металлические стержни с шинами; 7 — угольный анод; 8 — глинозем; 9 — жидкий электролит; 10 — корка затвердевшего электролита; 11 — катодная токо-подводящая шина; 12 — фундамент
Ванна имеет стальной кожух прямоугольной формы, а ее стену и подину изготавливают из угольных блоков, теплоизолированных шамотным кирпичом. В футеровку подины вмонтированы стальные катодные шины, благодаря чему угольный корпус ванны является катодом электролизера. Анодами служат самообжигающиеся, вертикально расположенные угольные электроды, погруженные в расплав. При электролизе аноды постепенно сгорают и перемещаются вниз. По мере сгорания они наращиваются сверху жидкой анодной массой, из которой при нагреве удаляются летучие и происходит ее коксование. Электролит нагревается до рабочей температуры 930—950 °С. Глинозем, расходуемый в процессе электролиза, периодически загружают в ванну сверху. Благодаря охлаждению воздухом на поверхности образуется корка электролита. На боковой поверхности ванны образуется затвердевающий слой электролита (гарнисаж), предохраняющий футеровку от разрушения и теплоизолирующий ванну. При высокой температуре глинозем AI2O3, растворенный в электролите, диссоциирует на ионы: А12О3=2А13++ O2- На поверхности угольной подины, являющейся катодом, ионы восстанавливаются до металла: 2Al3++6e=2al
По мере уменьшения содержания глинозема в электролите его периодически загружают в ванну электролизера. Жидкий алюминий скапливается на подине электролизера и периодически удаляется с помощью вакуумных ковшей.
Кислородные ионы разряжаются на угольном аноде: 3O2—6e=3/2O2, окисляют анод, образуя СО и СО2, которые удаляются вентиляционными устройствами. Электролизные ванны соединяют последовательно в серии из 100—200 ванн.
Первичный алюминий, полученный в электролизной ванне, загрязнен примесями Si, Fe, неметаллическими включениями (AI2O3,С), а также газами, преимущественно водородом. Для очистки алюминия его подвергают рафинированию либо хлорированием, либо электролитическим способом.
Более чистый алюминий получают электролитическим рафинированием, где электролитом являются безводные хлористые и фтористые соли. В расплавленном электролите алюминий подвергают анодному растворению и электролизу. Электролитическим рафинированием получают алюминий чистотой до 99,996 %,потребляемый электрической, химической и пищевой промышленностью. Еще более чистый алюминий(99,9999 %)можно получить зонной плавкой. Этот способ дороже электролиза, мало производителен и применяется для изготовления
небольших количеств металла в тех случаях, когда необходима особая чистота, например для производства полупроводников.
Дата добавления: 2015-04-25; просмотров: 1546;
