ОСОБЛИВОСТІ ДОСЛІДЖЕНЬ ЗЕРНОБОБОВИХ КУЛЬТУР
У зернобобових зазвичай відмічають такі фази росту та розвитку:
Сходи: з’являється сім’ядольний або справжній листок і рядки добре проглядаються (початком фази вважають перехід до неї 10% рослин, а повне настання фази – 75%). З цієї фази починають спостереження за формуванням симбіотичного апарату, відлік періоду вегетації, а у випадку зрідження посівів вирішується питання про перезакладку досліду.
Гілкування відмічають, коли з пазухи нижніх листків з’являється пагін другого порядку.
Бутонізація настає при появі перших бутонів на рослині. Дуже важливо не пропустити цю фазу в селекційному процесі самозапилювачів, оскільки у деяких культур, наприклад у сочевиці, запилення відбувається до розпускання квітки. У культур з суцвіттям типу голівки цю фазу відмічають при формуванні останньої.
Цвітіння реєструють при розпусканні квіток у пазусі нижнього листка, у конюшини та культур з аналогічним суцвіттям – при розпусканні перших квіток голівки.
Появу бобів фіксують, коли в пазусі нижнього листка закінчується ріст в довжину першого боба. У конюшини – початок зав’ядання квіток у голівці.
Повний налив насіння у зернових бобових культур відмічають коли боби нижнього та середнього ярусів виповнені, у сортів з детермінантним типом росту – при наливі насінин верхніх бобів. У зернових бобових в цій фазі, як правило, нижні листки жовтіють, але не опадають, рослини накопичують максимальну кількість органічної маси і елементів живлення. Потім відмічають опадання листків і недорозвиненість генеративних органів, відмирання малих корінців, а криві динаміки даних показників спадають. Відносно динаміки формування врожаю це найважливіша фаза розвитку зернобобових культур.
Повна стиглість – фізіологічна зрілість насіння, коли боби і насіння набувають характерного для виду і сорту забарвлення.
Фенологічні спостереження починають з фази сходів і проводять систематично через 2 дні протягом вегетації. При необхідності відмічають початок і повне настання фази. Результати спостережень заносять до журналу. У процесі фенологічних спостережень відмічають початок і ступінь ураженості рослин хворобами і пошкодження шкідниками, початок і ступінь вилягання, інші особливості формування врожаю.
За фенологічних спостережень іноді виділяють по 10 типових рослин на ділянці (40 у варіанті), відмічаючи їх пергаментними етикетками. Це важливо у селекційному процесі. Найчастіше спостереження ведуть за всіма посівами кожної ділянки. У гетерогенній популяції залежно від мети дослідження відмічають всі рослини, які цікавлять дослідника і ведуть спостереження за кожною з них. Виділяють рослини у фазі повних сходів.
Облік густоти стояння рослин і зрідженості посівів.
Для ведення обліку густоти стеблостою при звичайному рядковому та вузькорядному способах сівби виділяють постійні ділянки – по дві на кожному повторенні. Встановлюють рамки 50*50 см, відступивши 20% довжини від краю ділянки, і залишають їх на весь період вегетації. Облік густоти стояння однорічних культур проводять у фазі повних сходів і перед збиранням. У першому випадку розраховують повноту сходів – відношення насінин, що дали нормальні сходи, до числа висіяного схожого насіння. За густотою стояння рослин перед збиранням визначають зріджуваність посівів – відношення рослин, що випали перед збиранням до густини стояння у фазі сходів.
Для обліку густини стояння рослин при широкорядному способі сівби виділяють частини рядків. В посівах з міжряддями 45 см площі 1м2 відповідає довжина рядка 222 см, з міжряддями 60 см – 167, з міжряддями 70 см – 143 см. Кількість рослин на 10 м2 відповідає кількості тисяч рослин на 1 га.
Облікові ділянки виділяють за тим же принципом, що і в суцільних посівах. В невирівняних посівах на кожній ділянці по діагоналі бажано виділити по три частини.
Біометричний аналіз зразків рослин.
Більшість наукової інформації про вплив факторів, що вивчаються, на формування врожаю і його якість дослідник отримує з даних біометричного аналізу рослинних зразків.
Періодичність біометричних аналізів залежить від цілей і задач дослідження. Якщо в задачу входить вивчення динаміки формування і активності симбіотичного апарата та їх зв’язок з фотосинтетичною діяльністю посівів, то біометричний аналіз проб слід проводити не рідше ніж один раз на 10 днів протягом вегетації. Якщо необхідно виявити, наприклад, післядію бобових культур на урожай ячменю, то біометричний аналіз достатньо виконати один раз у фазі воскової стиглості зерна і визначити структуру урожаю у фазі повної стиглості.
Вирішальною умовою достовірності висновків з результатів спостережень і обліків є репрезентативність вибірки, тобто достатня кількість рослин, що відбираються в одну пробу, якщо для даної культури раніше така норма не була визначена, відбирають 100 рослин і аналізують їх по одній за усіма параметрами, проводять математичний обробіток даних, пошук репрезентативної вибірки за основними показниками біометричного аналізу. За об’єм репрезентативної вибірки приймають ту зону квадрату дисперсії, де вона робить вигин на плато. Для різних показників ця зона неоднакова, і ,відповідно, об’єм репрезентативної вибірки буде залежати від вибору показників. Зазвичай для більшості зернобобових культур репрезентативна вибірка складає 30-50 рослин з варіанта, в середньому 40 рослин.
На одній і тій же ділянці одночасно можуть бути потужно розвинені рослини, середні і пригноблені дрібні. Така закономірність спостерігається у всіх варіантах досліду. Якщо вибірку рослин вести довільно, то дослідник, особливо початківець, в контрольному варіанті підсвідомо, ненавмисно відбирає менш розвинені рослини, а в дослідних варіантах - більш розвинені відповідно до його робочої гіпотези. Далі, проводячи найретельніші обліки при аналізі проб, він отримує очікувані результати, в яких упевнений, хоч вони зовсім не відповідають дійсності. Відбувається науковий самообман. Фактично може бути і така ситуація, що якийсь досліджуваний варіант був гіршим за контрольний, а в ньому виявилися найбільш цікаві результати дослідження, але автор пропустив їх через порушення методики відбору рослин на біометричний аналіз.
Іноді площа листя і суха маса рослин у попередньому аналізі були такими ж або більшими, ніж у подальшому через 10 днів при сприятливих умовах росту і розвитку рослин. Це може відбутися тільки в тому випадку, якщо в перший аналіз відбирали найбільш потужні рослини, а в другий - середні і відстаючі у рості. Щоб уникнути цих помилок, необхідно проби відбирати випадковим методом наприклад по діагоналі ділянки через три або чотири кроки і брати по п'ять рослин, які виявилися, біля носка ноги при останньому кроці. Якщо програма досліджень передбачає визначення активності нітрогенази, то аналізують всі рослини, що потрапили в рамку. Рослини зрізують на рівні кореневої шийки (з метою меншої забрудненості ґрунтом) і до відбору моноліту розміщують у зволоженому зсередини целофановому пакеті, в який вкладають етикетку. За один прийом потрібно брати стільки проб, скільки можна проаналізувати за 3-4 години роботи. При більшій кількості варіантів проби в полі протягом доби відбирають двічі.
Аналіз надземних органів. Для визначенні середньої висоти рослин пробу вирівнюють по основам пагонів, укладають на лінійку чи мірну рейку і вимірюють довжину від основи стебел до середини конуса спаду їх висоти У селекційному процесі інколи необхідно виміряти кожну рослину. Для визначення площі листків листові пластинки рослин всієї проби відокремлюють від черешків. Черешки залишаються на стеблі, а листя негайно зважують, так як відокремлені від рослин, вони швидко втрачають тургор, відразу ж беруть пробу на вологість листя - 2-3 г сирої маси. Оскільки на кожній рослині є листки різного віку, їх ретельно перемішують і беруть середній зразок для визначення площі. Краще для цього використовувати електронний планіметр: середній зразок зважують і розправлені листові пластинки укладають на рухому стрічку. Прилад видає площу листя в сантиметрах квадратних. Площа всієї проби листя розраховують за формулою
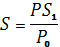 ,
,
де S – площа листків усієї проби, см2 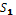 – площа листків середнього зразка, що аналізується, см2; Р – маса листків усієї проби, г;
– площа листків середнього зразка, що аналізується, см2; Р – маса листків усієї проби, г; 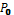 - маса листків середньої проби, г.
- маса листків середньої проби, г.
Найбільш поширений при визначенні площі листя метод висічок. Для цього в середню пробу відбирають 10 листових пластинок різного віку. Укладають їх на гумові подушки один на інший. Свердлом відомого діаметра роблять п'ять висічок, тобто в свердлі виявиться 50 дисків листка. Диски зважують на торсіонних вагах.
Знаючи кількість рослин в пробі і густоту стеблостою на 1 га, розраховують площу листків в тисячі м2 на 1 га. Не варто брати висічки на жилці у основи листка і на його вершині. В першому випадку площа буде занижена а в другому – завищена. Оптимальний варіант відбору висічок – середина довжини листка.
Найбільш сучасний і точний спосіб визначення площі листкової поверхні – за використання електронно-оптичного приладу конструкції В.Г. Дідори.
Одночасно з відбором середньої проби для визначення площі листків беруть середню пробу для їх хімічного аналізу. Маса проби становить 10-12 г. пробу розміщують в приготований раніше підписаний паперовий пакет і в сушильному боксі фіксують протягом 20 хвилин за температури 120̊ С а листки висушують.
При аналізі генеративних органів підраховують кількість бобів і насінин на одну рослину і один біб, визначають масу насінин і стулок. На початку генеративного періоду враховують кількість і масу бобів. Беруть їх середню пробу на вологість і хімічний аналіз. Фіксацію і просушування середніх зразків проводять так само як і листя.
Іноді залежно від цілей досліду облік генеративних органів ведуть за ярусами на головному та бокових пагонах. У цьому випадку рослину розподіляють на три яруси.
Стовбури та черешки зважують, подрібнюють на відрізки 1-2 см і плющать для прискорення і рівномірності висихання, також відбирають середній зразок для визначення вологості (маса 2-3 г) і для хімічного аналізу (10-12 г). пробу для хімічного аналізу фіксують і висушують так само як і листя.
Пакети при фіксації і висушуванні рослинних зразків мають бути відкритими, стояти в один ярус нещільно притисненими один до одного, в іншому випадку сушка буде відбуватися довго і нерівномірно. Проби для хімічного аналізу не зважують до і після сушки. Зазвичай вони висихають протягом 4-6 год.
Після висушування проби подрібнюють і розміщують в пакетики з детальним описом (культура, варіант, орган рослини, дата відбору, фаза).
Якщо біометричний аналіз проводять в три- або чотирикратній повторності, то для хімічного аналізу відбирають середню пробу кожного органа по варіанту.
Аналіз кореневої системи. До нього приступають після закінчення аналізу надземних органів. Особливу уваги приділяють ретельній очистці коренів від пиловидних часток ґрунту, які, як правило, щільно прилягають до їх поверхні. Для цього корні відмивають під слабким струменем води і використовують м’який пензлик. Відмиті корені висушують фільтрувальним папером і зважують. Пінцетом відділяють бульбочки, розділяючи їх на активні (з леггемоглобіном) і неактивні, підраховують і зважують. Корені подрібнюють на відрізки 1-2 см, розплющують і беруть середній зразок для визначення вологості і для хімічного аналізу. Бульбочки аналізують на вміст леггемоглобіну і вологість.
Для визначення вологості рослинних зразків використовують алюмінієві бюкси. До біометричного аналізу бюкси мають бути ретельно вимиті, висушені і відтаровані. Масу пустого, сухого, чистого бюкса записують на кришці і збоку з точністю до 0,01 г. Номера бюкса і кришки мають співпадати.
Проба на вологість повинна займати не більше половини бюкса, бажано . Матеріал, що аналізується не можна ущільнювати в бюксі. Рихлий зразок підсихає рівномірно і швидко. Зважують бюкс з пробою до і після сушки з точністю до 0,01 г. Нераціонально зважувати матеріал, що сушиться, кілька разів. При правильному відборі зразка, він досягає абсолютно сухого стану через 4 (листя) або 6 годин (стебла і корені) при температурі 105 ̊ С. Вміст бюксу не варто викидати до розрахунку вологості зразків. Часто при висушуванні і зважуванні бувають помилки, що ведуть до серйозного спотворення експериментальних даних.
Записи у журналі, як правило, ведуть за такою схемою: номер бюкса, маса пустого бюкса до сушки, маса бюкса після сушки, маса сирого зразка, маса води, що випарувалась, відсоток вологості.
Визначення тривалості загального і активного симбіозу.
Період від початку формування бульбочок до їх повного лізису називають тривалістю загального симбіозу, а період функціонування бульбочок з леггемоглобіном – тривалістю активного симбіозу. Оскільки леггемоглобін з’являється після утворення бульбочок і переходить в холеглобін до їх повного лізису, тривалість активного симбіозу завжди менша за тривалість загального симбіозу і різниця між цими величинами буде тим більша, чим менш сприятливі умови для активного симбіозу.
Параметри цих показників визначають за наступною методикою. Після появи сходів бульбочки у різних культур утворюються через різні проміжки часу: у гороха, вики, бобів – через 3-4 дні, у сої, квасолі – через 7-9 днів, у багаторічних бобових трав – через 10-12 днів. Початок формування бульбочок у вирішальній мірі залежить від параметрів основних факторів навколишнього середовища: рН ґрунту, вологозабезпеченості, температури. На кислих ґрунтах у більшості видів бобових бульбочки не утворюються. Те ж відмічається і при недостатній вологозабезпеченості.
Дату початку утворення бульбочок визначають через 4 дні після появи сходів: викопують по 10 проростків з шару ґрунту 10 см. Кореневу систему звільняють від ґрунту і промивають під струменем води. Аналізують стержневий корінь на наявність бульбочок. Оскільки вони дуже маленькі бажано використовувати лупу 3-5 кратного збільшення. Враховують кількість рослин з бульбочками. Відсоток рослин з бульбочками – нодуляція – вказує ступінь гетерогенності популяцій за сприйнятливістю або імунністю до ризобії, а також те, наскільки сприятливі та однорідні умови для утворення бульбочок.
Якщо першого разу бульбочки не виявлені, аналіз повторюють кожні 2 дні до початку їх утворення.
При вивченні культур, у яких бульбочки, як правило, з’являються через 7-10 днів після сходів, перший аналіз для визначення початку їх формування проводять у ці строки.
Після встановлення дати утворення бульбочок через кожні 2 дні їх аналізують на появу леггемоглобіну. Дату кінця активного симбіозу відмічають при набутті бульбочками рожевого кольору. Дату кінця активного симбіозу реєструють при позеленінні бульбочок – перехід леггемоглобіну в холеглобін. У більшості бобових це відбувається в стадії повного наливу насіння, у гороха посівного – найчастіше на початку наливу насіння, у сої – при побурінні бобів нижнього ярусу, а у деяких сортів – середнього ярусу.
При зниженні вологості ґрунту в середині вегетації до критичного рівня бульбочки відмирають, іноді повністю, і з’являються знову при відновленні вологості ґрунту до оптимальної по периферії кореневої системи. Це необхідно враховувати при визначенні тривалості загального і активного симбіозу.
Дату закінчення загального симбіозу відмічають при повному лізисі бульбочок.
Облік розташування бульбочок по кореневій системі.
Бульбочки бобових культур – це складна азотфіксуюча система, що включає в себе гіпертрофовану тканину кореня з бактеріальними клітинами, що вміщає леггемоглобін і ферментативний комплекс як продукт симбіозу.
В біологічній фіксації азоту непряму, але дуже важливу роль відіграє сама коренева система, по якій у бульбочки потрапляє енергетичний матеріал, вода та елементи живлення. Частина кореневої системи з розташованими на ній бульбочками називаються симбіотичним апаратом.
Розташування бульбочок по кореневій системі у різних культур неоднакове: у одних вони концентруються у головного кореня, ближче до поверхні ґрунту, у інших розташовані дисперсно. Отже, щоб повністю витягти симбіотичний апарат, необхідно знати особливості розміщення бульбочок по кореневій системі у різних рослин і враховуючи це розрахувати розміри моноліту.
Морфологія симбіотичного апарату залежить в першу чергу від видових особливостей культури і від параметрів основних факторів середовища. Для того щоб встановити генетично обумовлене розташування бульбочок по кореневій системі, необхідно забезпечити оптимальні умови для активного бобоворизобіального симбіозу даного виду: добра аерація (середньосуглинковий ґрунт); реакція ґрунту, близька до нейтральної, за виключенням кисло стійких видів; достатня забезпеченість рухомим фосфором, обмінним калієм, бором і молібденом; насіння перед посівом обробляють специфічним вірулентним активним штамом бульбочкових бактерій; вологість орного шару ґрунту підтримують в діапазоні 100% НВ до розриву капілярів.
У польових умовах рослини слід розміщувати квадратно-гніздовим способом на відстані 60 см одна від іншої, щоб при аналізі однієї рослини не пошкодити інші.
При вивченні вертикального розташування бульбочок по кореневій системі у зернових бобових культур чи багаторічних бобових трав у фазі початку цвітіння відбирають моноліт ґрунту діаметром 40 см по шарам 0-5, 5-10, 10-15, 15-20, 20-25, 25-30, у посухостійких видів з потужною стрижневою кореневою системою – 30-35, 35-40, 40-45 , 45-50, 50-55 см. Для цього на відстані 20 см від рослини викопують шурф шириною 40 см і глибиною 60 см з прямовисною стінкою. Стінку розмічають на шари по 5 см. З трьох інших сторін від рослини на відстані 20 см лопатою роблять вертикальні надрізи моноліту і зі сторони шурфа знімають верхній п’ятисантиметровий шар, використовуючи металічний сорока сантиметровий лист або лопату. Ґрунт поміщають у целофановий пакет з докладною етикеткою, потім так само знімають кожен наступний шар ґрунту.
Корні з бульбочками з кожного шару ґрунту відмивають під струменем води на ситі з діаметром отворів 1мм. Для видалення пиловидних часток ґрунту використовують м’який пензлик. Бульбочки відділяють від коренів, корені з бульбочками підсушують фільтрувальним папером, враховуючи кількість бульбочок, масу коренів і бульбочок з леггемоглобіном і без нього. У зв’язку з тим, що кожен вид і навіть сорт гетерогенні за цією ознакою, для забезпечення репрезентативності вибірки варто проаналізувати не менше ніж 10 рослин, що ростуть окремо, при вивченні культур з компактним симбіотичним апаратом достатня 5-7 кратна повторність.
У дослідженнях однорічних зернових бобових культур глибина шурфу, як правило, складає 25 см. В деяких випадках для люпину жовтого, білого, вузьколистого вона може бути збільшена до 45 см. Для визначення горизонтального розміщення бульбочок в тій самій фазі викопують моноліт розміром 50*50 см на глибину їх вертикального розміщення. Моноліти розміщують у воді на 6-8 год. і обережно відмивають струменем води на ситах з діаметром отворів 1 мм. Відмиту кореневу систему з бульбочками розміщують на папері, намагаючись зберегти природне розташування коренів.
Бокові корені обрізують по вертикалі в радіусі 15 см від головного кореня. Підраховують бульбочки, в тому числі активні, розташовані на відстані більше 15 см, зважують корені. Потім так само аналізують шари 10-15, 5-10, 2-5, 0-2см, встановлюють кількість і масу бульбочок на головному корені. Повторність 5-6 кратна. Одночасно визначають вміст леггемоглобіну в бульбочках.
Визначення розміру моноліту при аналізі симбіотичного апарату.
До п`ятої групи відносяться культури з найбільш компактним симбіотичним апаратом: соя і квасоля. Шароподібні бульбочки цих культур розташовані в шарі до 10-12 см при радіусі 12 см.
Таке розміщення бульбочок по кореневій системі бобових культур спостерігалось в умовах, сприятливих для симбіозу. При несприятливих умовах горизонтальне розміщення бульбочок трохи змінюється. Якщо весною випадає небагато опадів і вологість ґрунту в травні падає нижче критичного мінімуму (50% НВ), бульбочки на головному корені не утворюються. Після випадання опадів бульбочки з`являються на бічних коренях і тим більше, чим довше був посушливий період. Але максимальне віддалення їх не виходять за границі, характерні для даної культури. При цьому глибина утворення нижніх бульбочок не змінюється.
На важких ґрунтах або в умовах перезволоження бульбочки практично всіх культур концентруються у верхньому 3-5 сантиметровому шарі при тому ж радіусі поширення. На легких ґрунтах і в роки з недостатньою зволоженістю основна маса бульбочок формується у нижньої границі поширення.
На кислих бідних ґрунтах формуються одиничні бульбочки або зовсім не формуються. Вапнування кислих ґрунтів, підвищення забезпеченості фосфором, калієм, бором сприяє значному збільшенню маси бульбочок. Азотні добрива затримують їх утворення і тим довше, чим вища доза азоту. При внесенні 70-165 кг мінерального азоту на 1 га формування бульбочок у однорічних зернобобових культур затримується до бутонізації, цвітіння, а при дозі 200-300 кг на 1 га – до наливу зерен. У цих випадках вони також утворюються по периметру границі, що властива даній групі культур. Як правило, бульбочки , що утворились, дрібні та функціонують короткий час.
Аналізуючи морфологію симбіотичного апарату, ми відмітили наявність кореляційних зв’язків між формою бульбочок і розташуванням їх на кореневій системі. Чим менше гілкуються бульбочки, тим вище вони розташовані. Ця кореляційна залежність обумовлена, на наш погляд, величиною питомої поверхні бульбочки і ступенем аерації ґрунту. Кисень потрапляє в бульбочки з ґрунтового повітря через їх поверхню. Шаровидна форма бульбочок п`ятої групи має найменшу питому поверхню і, вірогідно, тому вони розміщуються в верхньому, більш керованому шарі.
Облік величини симбіотичного апарату в широкорядних і суцільних посівах. У польових дослідах іноді необхідно знати масу бульбочок в розрахунку на 1 га. Її можна визначити за масою бульбочок на одиниці площі. Для культур звичайного рядкового і вузькорядного посівів найбільш зручним є метод перерахунку на площу. Для цього металічну рамку 300*167 мм (0.05 м2) розміщують так, щоб в неї потрапили три рядки при рядковому посіві, чотири при вузькорядному , а короткі бокові грані рядка знаходились на середині міжрядь. Висота моноліту має відповідати глибині поширення бульбочок культури, що вивчається. У цьому випадку в моноліт потрапляють корені з бульбочками не лише рослин, що знаходяться в рамці, але і сусідніх, а частина коренів з бульбочками рослин, що вивчаються, виявляється поза монолітом. Корені з бульбочками відмивають від ґрунту і визначають масу всіх бульбочок моноліту. Знаючи площу моноліту і середню густину стояння рослин, можна встановити масу бульбочок на 1 га і на рослині. Масу бульбочок на 1 га (М, кг/га) розраховують за формулою:
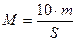 ,
,
де m – маса бульбочок в моноліті; S – площа моноліту, м2; 10 – коефіцієнт перерахунку г/м2 в кг/га.
Якщо площа моноліту 0,05 м2, то маса бульбочок на 1 га дорівнює 200m кг. У випадку, коли травостій не вирівняний, спочатку визнають коефіцієнт вирівняності.
Широкорядним способом (з міжряддями 45 см) зазвичай висівають сою, квасолю і люпин білий. При такому міжрядді в моноліт площею 0,1 м2 увійде лише один рядок довжиною 22,2 см. Оскільки діаметр поширення бульбочок сої і люпину не перевищує 25 см, а кормових бобів – 30 см, ширину моноліт, не знижуючи точності досліду, можна скоротити з 45 відповідно до 25 і 30 см. Площа такого моноліту буде відповідати 0,1 м2, а маса бульбочок становитиме 100m кг/га. При міжрядді 70 см довжина рядка в моноліті при площі 0,1 м2дорівнює 14,3 см.
Для розрахунку маси бульбочок на рослині необхідно середню масу бульбочок моноліту поділити на середню густоту стояння рослин.
Кількість монолітів визначається густотою стояння рослин, об`ємом стояння вибірки і площею моноліту. Наприклад, при густині стеблостою сої 400000 на 1 га і площі моноліту 0,01м2 необхідно відібрати 8 монолітів, тобто по два в кожній повторності. На достатньо вирівняних посівах їх число може бути знижено до шести. Для культур суцільного способу сівби з більшою густиною стеблостою, де в 1 моноліті площею 0,05 м2 розміщується 8-10 рослин, кількість монолітів маж бути не менше 6 для уникнення зниження рівня репрезентативності. При вивченні динаміки формування симбіотичного апарату рослинні зразки доводиться брати часто – через 7-10 днів. У дослідженнях культур широкорядного посіву з компактним симбіотичним апаратом відбір монолітів можна спростити. Для цього лопаткою викопують моноліти з обох сторін рядка на відстані 12-13 см від рослини. В один моноліт відбирають 3-4 рослини. Довжина його має бути такою, щоб відстань від найближчої облікової рослини до кінця моноліту було не менше за радіус поширення бульбочок. Корені інших рослин, що опинилися в цій зоні, при відмиванні видаляють з моноліту і не включають в облік.
Інокуляція насіння.
Насіння бобових культур інокулюють специфічним вірулентним і активним штамом бульбочкових бактерій.
Інокулюм, або культуру бактерій, і ризоторфін зберігають в холодильнику при температурі 3-5º С або в іншому темному, сухому, прохолодному приміщенні. Не допускається заморожування препарату. Термін придатності ризоторфіну 6 місяців.
Інокуляцію насіння проводять в день посіву, так як титр бактерій на насінні швидко знижується.
Чисті культури бульбочкових бактерій для інокуляції насіння вирощують в пробірках на косяках агару при температурі 28-27 º С: бактерії, що швидко ростуть, на бобовому агарі, а ті що ростуть повільно – на агарі з люпиновим борошном. На п`ять крупних насінин готують одну пробірку. Бактерії, що повільно ростуть, витримують в термостаті протягом 8-9 днів, швидкоростучі можуть бути використані для інокуляції на 4 день.
Перед інокуляцією в кожну пробірку вносять по 5 мл. стерильного фізіологічного розчину. Мікробіологічною петлею проводять розмноження бульбочкових бактерій в фізіологічному розчині. Суспензію ретельно збовтують а пробірки загортають у темний папір для уникнення потрапляння сонячних променів. Суспензією бульбочкових бактерій за допомогою дозатора або піпетки на 1 мл обробляють кожну насінину, що розміщена на глибині 0,5-3 см. Інокульоване насіння бобових рослин засипають субстратом , поверхню вирівнюють.
Визначення кількості бульбочкових бактерій.
Облік кількості бульбочкових бактерій можна проводити шляхом прямого мікроскопування їх суспензії з використанням карболового еритрозину.
Наважку 1 г бульбочок стерилізують в 96%-ому спирті, потім ретельно промивають дистильованою водою і розтирають стерильним пестиком у стерильній порцеляновій ступці з невеликою кількістю стерильної водопровідної води. Отриману суспензію переносять в колбу Ерленмейера на 250 мл і стерильною водою доводять об`єм суспензії, що вивчається, до 50 мл. Ватну пробку заміняють гумовою, струшують протягом 5 хвилин, дають осісти отриманій суспензії, за допомогою стерильної піпетки переносять 0,01 мл суспензії на добре знежирене скло. Одночасно із суспензією на скло поміщають краплю 0,1 %-ного розчину агару Дифко на дистильованій воді. Агар і суспензію змішують і стерильним покривним склом розподіляють на площі 4 см2 по трафарету.
Трафарет роблять так: на міліметровому папері за допомогою туші заштриховують 4 см2 і папір приклеюють до предметного скла з нижньої сторони.
Препарат сушать, фіксують 96%-вим спиртом і фарбують карболовим еритрозином(від 30 хвилин до доби). При фарбуванні скло поміщають в розчин еритрозину, залишки барвника змивають, опускаючи скло в дистильовану воду тильною стороною. Потім препарат знову сушать і проглядають під мікроскопом з імерсійною системою. Можна також використовувати фуксин, генціан фіолетовий. Добрі результати дає використання суміші (1:1) розчину фуксину і метиленового синього у 1%-вій оцтовій кислоті. Забарвлення проводять протягом 3-5 хв, при цьому тканина бульбочки набуває синього кольору, а бактерії – червоного.
Для отримання більш точних результатів підраховують клітини в 10 полях зору мікроскопу і вираховують середню кількість клітин в 1 полі. Одночасно встановлюють площу поля зору мікроскопа. Діаметр його вимірюють за допомогою об`єктивного мікрометра. Потім визначають, скільки полів зору (К) розміщується на площі мазка. Середнє число клітин в полі зору множать на К і отримують кількість клітин в 0,01 мл суспензії, що досліджується.
Дата добавления: 2015-04-25; просмотров: 2983;
