Экспериментальные изотермы. Критические состояния
Уравнение Ван-дер-Ваальса – алгебраическое уравнение третьей степени относительно объема. Для одного моля газа
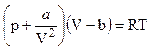 .
.
Раскрыв скобки и расположив члены уравнения по убывающим степеням объема, можно записать последнее в следующем виде:
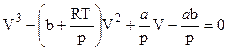 . (9.2.1)
. (9.2.1)
 |
Это уравнение третьей степени относительно объема и, следовательно, при данных р и Т оно может иметь или три вещественных корня, или один вещественный и два комплексно-сопряженных корня, не имеющих физического смысла. Это зависит от соотношения между коэффициентами. При низких температурах уравнение имеет три вещественных корня и график p=f(V) имеет вид, изображенный на рис. 9.3.
Для того чтобы получить изотерму опытным путем, нужно взять вещество в газообразном состоянии, поместить его в сосуд с перемещающимся поршнем и начать медленно сжимать, делая одновременно отсчеты давления и объема, а также, следя за тем, чтобы температура вещества оставалась постоянной. Результат подобного опыта дан на рис. 9.3 (линия 1-2-3-4).
Вначале с уменьшением объема давление газа растет, причем ход изотермы хорошо описывается уравнением Ван-дер-Ваальса (9.2.1) (на рис. 9.3 линия 1-2).
Однако, начиная с некоторого объема V3, экспериментальная изотерма перестает следовать уравнению (9.2.1) (на рис. 9.3 линия 2-А). Состояние 2 –А (пересыщенный пар) создается при сжатии газа, в котором отсутствуют центры конденсации (пылинки, электрические заряды и пр.). Начиная с этого значения объема, давление в сосуде перестает изменяться, само вещество перестает быть однородным, часть газа конденсируется в жидкость. Происходит расслоение вещества на две фазы: жидкую и газообразную (на рис. 9.3 линия 2-3).
По мере дальнейшего уменьшения объема все большая часть вещества переходит в жидкую фазу, причем переход осуществляется при постоянном давлении, обозначенном на рисунке рнп. Состояние 3-В (перегретая жидкость) возникает с уменьшением давления жидкости при отсутствии центров парообразования.
После того, как процесс конденсации вещества в жидкость заканчивается при V=V1, дальнейшее уменьшение объема сопровождается быстрым ростом давления. При этом ход изотермы снова примерно следует уравнению (9.2.1). Вещество в состояниях, соответствующих этому участку изотермы, снова будет однородным, но представляет собой не газ, а жидкость (на рис. 9.3 линия 3-4).
Таким образом, уравнение Ван-дер-Ваальса описывает не только газообразное состояние вещества, но охватывает также процесс перехода в жидкое состояние и процесс сжатия жидкости.
 |
Сопоставление экспериментальной изотермы (рис. 9.4) с теоретической изотермой Ван-дер-Ваальса дает, что эти изотермы довольно хорошо совпадают на участках, отвечающих однофазным состояниям вещества, но ведут себя совершенно различным образом в области расслоения на две фазы.
Вместо S-образного завитка на изотерме Ван-дер-Ваальса экспериментальная изотерма имеет в этой области прямолинейный горизонтальный участок (рис. 9.4).
В состояниях, соответствующих горизонтальному участку изотермы, наблюдается равновесие между жидкой и газообразной фазами вещества. Газ, находящийся в равновесии со своей жидкостью, называется насыщенным паром. Давление рнп, при котором может существовать равновесие при данной температуре, называется давлением насыщенного пара.
Опыт показывает, что с повышением температуры (T¢<T¢¢<T¢¢¢<Tк) горизонтальный участок изотермы сокращается и при некоторой температуре он стягивается в точку. Называется эта температура критической (рис. 9.4). При этом уменьшается различие в удельных объемах, а, следовательно, и в плотностях жидкости и насыщенного пара.
При критической температуре это различие исчезает. Одновременно исчезает всякое различие между жидкостью и паром. Если провести линию через крайние точки горизонтальных участков изотерм, получается колокообразная кривая, ограничивающая область двухфазных состояний вещества. Колокообразная кривая и участок критической изотермы, лежащий слева от точки К делит диаграммы (pV) на три области (рис. 9.5).
 |
Наклонной штриховкой помечена область однородных жидких состояний. Под колокообразной кривой располагается область двухфазных состояний и область, лежащая справа от колокообразной кривой и верхней ветви критической изотермы, представляет собой область однородных газообразных состояний вещества. Особо следует отметить область, лежащую под правой ветвью критической изотермы – область пара (рис. 9.5).
Состояние вещества в этой области отличается от остальных газообразных состояний в том отношении, что при изотермическом сжатии вещество, находящееся в этом состоянии, претерпевает процесс сжижения. Вещество, находящееся в газообразном состоянии при температуре выше критической, не может быть сжижено никаким сжатием.
Рассмотрим изотермы, построенные на основании уравнения Ван-дер-Ваальса для нескольких значений температуры (рис. 9.6). Расчеты показывают, что при температуре T¢ коэффициенты в уравнении (9.2.1) таковы, что все три решения уравнения оказываются вещественными. С повышением температуры различие между тремя вещественными решениями уравнения (9.2.1) уменьшаются.
 |
Начиная с определенной, своей для каждого вещества, температуры Ткр, при любом давлении вещественным остается только одно решение, соответствующее точке К. Температура называется критической температурой. Точка К называется критической точкой.
Для соответствующей изотермы точка К служит точкой перегиба. Ей соответствуют три совпадающих вещественных решения уравнения (9.2.1). Касательная к критической изотерме в точке К является пределом, к которому стремятся секущие p¢ и p¢¢ при приближении температуры к критической. Следовательно, эта касательная, как и все секущие параллельна оси V так, что производная 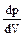 в точке К равна нулю.
в точке К равна нулю.
Кроме того, в точке перегиба должна быть равна нулю и вторая производная 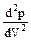 . Запишем уравнение (9.2.1) в виде
. Запишем уравнение (9.2.1) в виде
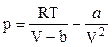 . (9.2.2)
. (9.2.2)
Дифференцирование этого выражения по V дает
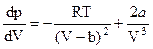 ;
;
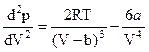 .
.
В критической точке при Т=Ткр и V=Vкр эти выражения обращаются в ноль:
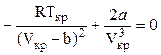 ;
;
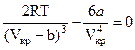 .
.
Соответствующие значения и ркр носят название критического объема и критического давления для данного вещества. Из уравнения (9.2.2) находим
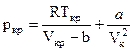 .
.
Решая систему трех уравнений с тремя неизвестными Vкр, pкр и Ткр, получим
Vкр = 3b;
pкр = 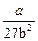 ;
;
Ткр = 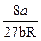 .
.
Таким образом, зная константы Ван-дер-Ваальса a и b, можно найти соответствующие критической точке Vкр, pкр и Ткр, которые называют критическими величинами. И наоборот, по известным критическим величинам могут быть найдены значения констант Ван-дер-Ваальса.
Дата добавления: 2015-04-19; просмотров: 1440;
