Опытные законы идеального газа. Газовые законы установлены в 17 веке экспериментально
Газовые законы установлены в 17 веке экспериментально. Однако, их можно получить, используя уравнение Менделеева - Клапейрона.
Закон Бойля-Мариотта. Для данного количества вещества при изотермическом процессе произведение давления на объём есть величина постоянная.
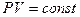 (7-1) .
(7-1) .
 Для построения диаграммы Р(V) выразим давление через объем
Для построения диаграммы Р(V) выразим давление через объем 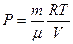 .
.
Зависимость между давлением и объёмом – обратно пропорциональная, графически представлена гиперболой на рис.7.2 а. Температурные зависимости давления и объёма представлены на рис.7.2 б и в, соответственно.
Закон Гей-Люссака. Для данного количества вещества при изобарическом процессе отношение объёма к температуре (или наоборот) есть постоянная величина.
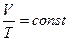 (7-2)
(7-2)

Изобарический закон можно записать и в виде: 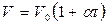 . Здесь V0 - объём газа при t=00C, t- температура в 0С, a - термический коэффициент объемного расширения;
. Здесь V0 - объём газа при t=00C, t- температура в 0С, a - термический коэффициент объемного расширения; 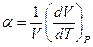 . Для идеального газа
. Для идеального газа  ,
,  , но
, но 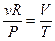 , тогда
, тогда 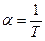 - термический коэффициент объёмного расширения идеального газа равен величине, обратной температуры. Изображение этого процесса приведено на рис. 7.3.
- термический коэффициент объёмного расширения идеального газа равен величине, обратной температуры. Изображение этого процесса приведено на рис. 7.3.
Закон Шарля.Для данного количества вещества при изохорическом процессе отношение давления к температуре (или наоборот) есть величина постоянная.
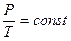 , (7-3)
, (7-3)
Изображение этого процесса приведено на рис. 7.4

Закон Авогадро
Дата добавления: 2015-04-15; просмотров: 940;
