Основные положения МКТ.
Молекулярная физика изучает физические свойства макроскопических систем. Предметом её изучения являются молекулярные формы движения больших совокупностей молекул.
В основе молекулярной физики лежит понятие молекулы. Основные положения молекулярно-кинетической теории поясняют суть этой теории. Эти положения подтверждены практикой.
1. Все вещества состоят из частиц (молекул)
Опытное подтверждение этого положения:
· Смешивание разных жидкостей, например, воды и спирта, показывает, что объём смеси меньше суммарного объёма, занимаемого двумя жидкостями до их смешивания. Это можно объяснить тем, что между молекулами жидкостей есть пустоты, и при смешивании жидкостей молекулы одной из них проникают в свободное пространство между молекулами другой жидкости.
· Расширение тел при нагревании и сжатие при охлаждении также можно объяснить тем, что вещества состоят из молекул, расположенных друг от друга на некотором расстоянии. При нагревании расстояния между молекулами увеличиваются, а при охлаждении уменьшаются.
· Проявление дискретной структуры при наблюдении веществ под электронными или ионными микроскопами.
2. Частицы (молекулы) взаимодействуют друг с другом.
Факты, подтверждающие это положение:
· наличие сил притяжения и отталкивания;
· существование трех агрегатных состояний: из-за разного взаимодействия молекул проявляются разные свойства агрегатных состояний, отражённые в таблице:
| газ | не имеет собственной формы и объема |
| жидкость | не имеет собственной формы, но имеет собственный объём |
| твердое тело | имеет собственную форму и объем |
3. Частицы (молекулы) непрерывно и беспорядочно движутся
Некоторые факты, подтверждающие это положение:
· молекулы газа распространяются по всему объему сосуда;
· броуновское движение;
· диффузия.
Что представляют собой те частицы, из которых составлены вещества?
Молекула- это наименьшая частица вещества, сохраняющая все его химические свойства. Различают молекулу в физическом смысле (физическую молекулу), которую можно уподобить упругому шарику, и химическую молекулу, выраженную формулой атомного состава. Молекулы не всех веществ можно рассматривать как физические, например, молекулы веществ с ионной связью (в частности, NaCl – повареная соль). Это важно, когда рассматриваются соударения молекул или их тепловое движение. Поэтому в формулировке основных положений МКТ чаще всего используют термин «частица».
Размеры молекул очень малы. Если представить молекулу в виде малого шарика, то его радиус имеет порядок величины10 – 8 см =10 – 10 м. Молекулы состоят из атомов. Частицы, образующие атомы - электроны и ядра. Принято считать, что электрон имеет радиус порядка величины 10 – 11 см = 10 – 13 м, а ядра имеют радиусы примерно »10 – 12 ÷ 10 – 13 см = 10 – 14 ÷10 –15 м.
Массы атомов и молекул
В качестве единичной атомной массы mат принимается 1/12 массы атома ядра изотопа углерода 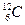 :
: 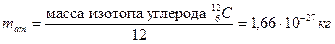
Относительная молекулярная масса, или относительная масса молекулы, есть отношение массы молекулы к единичной атомной массе:
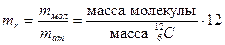
Аналогично определяют и относительную атомную массу.
Абсолютные значения атомных масс по порядку величины заключаются в пределах 10 –25 ÷ 10 –27 кг, а относительные атомные массы в пределах 1÷102. Пределы относительных молекулярных масс mr от 1 до 105.
Количество вещества. Количество вещества характеризуется числом его структурных элементов. В СИ оно выражается в молях. Моль является основной единицей измерения, так же как метр и секунда.
Моль равен количеству вещества рассматриваемой системы, которое содержит столько же структурных элементов, сколько атомов содержится в 0,012 кг изотопа углерода 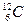 .
.
Понятие моля относится к числу структурных элементов вещества. Поэтому нужно говорить: «моль молекул», «моль атомов», «моль электронов» и т.п.
Таким образом, моль любого вещества содержит одинаковое число структурных элементов. Это число называется постоянной Авогадро или числом Авогадро:
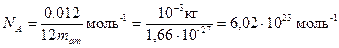
Отсюда следует: 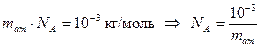
Молярная масса –масса одного моля молекул вещества.
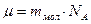
Её определяют через относительную массу молекулы:
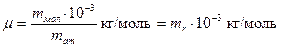
Число молей молекул n связано с числом молекул N некоторого вещества формулой:
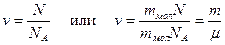 , где
, где 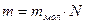 - масса вещества.
- масса вещества.
 Агрегатные состояния вещества
Агрегатные состояния вещества
Наличие разных агрегатных состояний вещества объясняется различным взаимодействием молекул. На рис.7.1 приведена зависимость сил межмолекулярного взаимодействия от расстояния.
На больших расстояниях преобладает действие сил притяжения, на малых - отталкивания. По природе эти силы - электромагнитные. С энергетической точки зрения, чем больше кинетическая энергия атомов, тем сильнее тенденция к разъединению, отталкиванию; чем больше потенциальная энергия сцепления, тем больше тенденция к соединению.
Если суммарная кинетическая энергия атомов и молекул много больше суммарной потенциальной энергии их взаимного притяжения, то вещество находится в газообразном состоянии; если много меньше, то в твердом. Жидкое состояние образуется при примерном равенстве этих энергий.
Дата добавления: 2015-04-15; просмотров: 1892;
