Характеристика стадий ПЦР
| Стадия | Температура, 0С | Экспо-зиция | Описание стадии | |
| Начальная денатурация | 90–95 | 3–10 мин | Большие двухцепочечные молекулы ДНК раскручиваются с образованием одноцепочечных молекул. | |
| 25–40 циклов | денатурация | 90–95 | 25с– 1 мин | Небольшие двухцепочечные ампликоны раскручиваются с образованием одноцепочечных молекул. |
| отжиг | 48–65[i] | 25с– 4 мин | Праймеры прикрепляются к комплементарным фрагментам ДНК-матрицы, образуя дуплексы. | |
| элонгация | 25с- 4 мин | ДНК полимераза прикрепляется к 3’-концу праймера, соединившегося с ДНК-матрицей, и синтезирует копию, комплементарную ДНК-матрице. | ||
| Конечная элонгация | 5-10 мин | Образуются дуплексы ДНК. | ||
| Хранение | - | - |
Примечание. температура отжига зависит от нуклеотидного состава праймера и рассчитывается математически.
 4 этап. Визуализация получаемых копий ДНК и регистрация результатов реакции.Образуемый высококонцентрированный раствор ампликонов ДНК прозрачен. Поэтому для выявления ДНК проводят электрофорез в агарозном геле, содержащем флюоресцирующий в УФ-свете ДНК-краситель - бромид этидия. ДНК движется в электрическом поле, взаимодействует с этидием бромидом и при просматривании в трансиллюминаторе (источник УФ света) выглядит в виде светящейся оранжевой полоски. Полученные результаты можно документировать, фотографируя электофореграммы с использованием оранжевого светофильтра.
4 этап. Визуализация получаемых копий ДНК и регистрация результатов реакции.Образуемый высококонцентрированный раствор ампликонов ДНК прозрачен. Поэтому для выявления ДНК проводят электрофорез в агарозном геле, содержащем флюоресцирующий в УФ-свете ДНК-краситель - бромид этидия. ДНК движется в электрическом поле, взаимодействует с этидием бромидом и при просматривании в трансиллюминаторе (источник УФ света) выглядит в виде светящейся оранжевой полоски. Полученные результаты можно документировать, фотографируя электофореграммы с использованием оранжевого светофильтра.
 Проведение электрофореза (рис. 34, 35). Агарозный гель (0,5–4%) с лунками для образцов опускают в аппарат для проведения электрофореза, так чтобы лунки находились в области катода. В камеру для электрофореза заливают трис-ацетат-ЭДТА буфер так, чтобы толщина слоя жидкости над гелем составляла 1-2 мм. Образец смешивают с загрузочным красителем в соотношении 1:6 и вносят 6 – 20 мкл в лунку в геле. Обычно одновременно исследуют много образцов. Загрузочный краситель (зеленый, синий) имеет скорость движения, схожую с ДНК, поэтому по его перемещению судят о местонахождении ДНК в геле. В зависимости от плотности тока время проведения электрофореза составляет от 30 мин до 24 ч. После проведения электрофореза гель вынимают из камеры и переносят на столик трансиллюминатора, где бромистый этидий, связавшийся с ДНК, флюоресцирует в УФ-свете (230 нм), давая оранжевое свечение.
Проведение электрофореза (рис. 34, 35). Агарозный гель (0,5–4%) с лунками для образцов опускают в аппарат для проведения электрофореза, так чтобы лунки находились в области катода. В камеру для электрофореза заливают трис-ацетат-ЭДТА буфер так, чтобы толщина слоя жидкости над гелем составляла 1-2 мм. Образец смешивают с загрузочным красителем в соотношении 1:6 и вносят 6 – 20 мкл в лунку в геле. Обычно одновременно исследуют много образцов. Загрузочный краситель (зеленый, синий) имеет скорость движения, схожую с ДНК, поэтому по его перемещению судят о местонахождении ДНК в геле. В зависимости от плотности тока время проведения электрофореза составляет от 30 мин до 24 ч. После проведения электрофореза гель вынимают из камеры и переносят на столик трансиллюминатора, где бромистый этидий, связавшийся с ДНК, флюоресцирует в УФ-свете (230 нм), давая оранжевое свечение.
5 этап. Анализ и интерпретация результатов реакции (рис. 36).Для оценки результатов учитывают опытные лунки, а также лунки с положительным и отрицательным контролем (рис. 37, табл. 14).

Рис. 36. Автоматизированная система визуализация гелей –
трансиллюминатор, видеокамера, компьютер
|
|
При интерпретации результатов ПЦР следует помнить, что могут быть получены как ложноположительные, так и ложноотрицательные результаты.
Ложноположительные результаты могут наблюдаться в результате контаминации при нарушении правил проведения ПЦР. Ложноотрицательные результаты могут наблюдаться в результате снижения чувствительности ПЦР при ингибировании реакции компонентами биологических образцов.
Модификации ПЦР:
1) классическая(specific PCR) - амплификация участков ДНК размером до 5000 п.о. с использованием одной пары праймеров.
2) мультипраймерная (multiplex PCR) – одновременное использование нескольких пар праймеров в одной реакционной пробирке. Это позволяет проводить одновременную амплификацию ДНК различных возбудителей, что сокращает время и расход реактивов. Например, мПЦР для диагностики гнойных менингитов одновременно определяет ДНК наиболее вероятных возбудителей бактериальных менингитов: Neisseria meningitides, Haemophilus influenzae, Streptococcus pneumoniae.
3) широкодиапазонная -использование универсальных праймеров, взаимодействующих с высоко консервативными участками ДНК, встречающимися у многих микроорганизмов. Применяют для выявления в клиническом материале от больного микроорганизмов, в том числе неизвестных и некультивируемых. Обычномишенью для ПЦР являются гены, кодирующие рибосомы 16S и 23S, имеющие сходную структуру у различных прокариот.
4) с обратной транскрипцией–используется для обнаружения РНК у РНК-вирусов. Первоначально при помощи РНК-зависимой ДНК-полимеразы (обратной транскриптазы или ревертазы) синтезируют комплементарную ДНК, которую затем используют в стандартной ПЦР.
5) гнездовая– обладает большей чувствительностью и специфичностью, т. к. проводится последовательно с двумя разными парами праймеров. ДНК продукты, образуемые в первой ПЦР, взаимодействуют со второй парой праймеров.
6) в реальном времени –используетсядля определения точечных мутаций, количественного содержания ДНК в пробе, а также для определения уровня экспрессии генов. Этот тип ПЦР находит все большее распространение, так как выявление ампликонов осуществляется по флюоресценции зондов либо красителя SybrGreen и не требует проведения электрофореза (сокращается время и трудоёмкость анализа).
7) ПП-ПЦР или ПЦР с использованием произвольных праймеров (RAPD-анализ полиморфизма случайно амплифицированной ДНК)– основана на использовании коротких праймеров, длиной 9–10 п. о., способных связаться с разными участками ДНК при низкой температуре отжига. В результате RAPD-анализа происходят амплификации нуклеотидных последовательностей в различных областях генома и образуются многочисленные фрагменты разной длины, по количеству и размерам которых судят о групповой или видовой принадлежности микроорганизма.
8) ассиимметричная – один из праймеров берут в концентрации в 10 раз большей, чем другой, чем добиваются преобладания среди продуктов реакции одноцепочечных ДНК над дуплексами.
Дата добавления: 2015-02-23; просмотров: 2050;

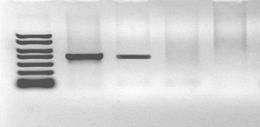 1 2 3 4 5
Рис. 37. Электрофореграмма продуктов ПЦР при диагностике возбудителя бактериальной инфекции:1- маркер молекулярного веса; 2 - положительный контроль; 3 – результат положительный; 4 - результат отрицательный; 5 – отрицательный контроль
Рис. 24. Электрофореграмма продуктов ПЦР при диагностике возбудителя бактериальной инфекции:1-3 – результат положительный; 4, 5 – результат отрицательный; 6 – отрицательный контроль; 7
– положительный контроль.
1 2 3 4 5
Рис. 37. Электрофореграмма продуктов ПЦР при диагностике возбудителя бактериальной инфекции:1- маркер молекулярного веса; 2 - положительный контроль; 3 – результат положительный; 4 - результат отрицательный; 5 – отрицательный контроль
Рис. 24. Электрофореграмма продуктов ПЦР при диагностике возбудителя бактериальной инфекции:1-3 – результат положительный; 4, 5 – результат отрицательный; 6 – отрицательный контроль; 7
– положительный контроль.