Смеси реальных газов
Реальным газом называется такой газ, у которого между молекулами существуют силы сцепления и объем, занимаемый молекулами, имеет конечное значение. При малых давлениях и высоких температурах реальный газ близок по своим свойствам к идеальному газу. При больших давлениях и низких температурах поведение реального газа не может быть описано закономерностями, справедливыми для идеальных газов. Получение точного уравнения состояния реального газа – проблема, которая полностью не решена до сих пор. Одним из первых уравнений характеризующих состояние реального газа является уравнение, предложенное в 1873 г. голландским физиком Ван-дер-Ваальсом. При выводе своего уравнения Ван-дер-Ваальс попытался учесть влияние сил взаимодействия между молекулами реального газа и конечность объема его молекул. Это уравнение имеет вид: 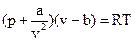 , где а и b – коэффициенты, зависящие от природы газа;
, где а и b – коэффициенты, зависящие от природы газа; 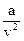 , называемый внутренним давлением, учитывает наличие сил сцепления между молекулами реального газа; коэффициент b характеризует конечность объема самих молекул. В силу того, что Ван-дер-Ваальс не учитывал всех особенностей взаимодействия молекул реального газа, его уравнение является лишь качественно верным.
, называемый внутренним давлением, учитывает наличие сил сцепления между молекулами реального газа; коэффициент b характеризует конечность объема самих молекул. В силу того, что Ван-дер-Ваальс не учитывал всех особенностей взаимодействия молекул реального газа, его уравнение является лишь качественно верным.
Советскими учеными М.П. Вукаловичем и И.И. Новиковым в 1939 г. было получено уравнение для реальных газов с учетом ассоциации и диссоциации их молекул. В общем виде это уравнение записывается в следующей форме: 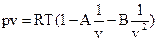 . Коэффициенты А и В определяются из равенства:
. Коэффициенты А и В определяются из равенства:
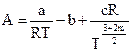 ;
;
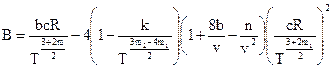 .
.
где m1, m2, c, k, n – коэффициенты, характеризующие степень ассоциации.
Приведенные уравнения можно применять к любому реальному газу. Но в связи с тем что практически использовать эти уравнения трудно из-за сложности, с их помощью вычислены значения основных физических величин перегретого пара при различных р и Т, составлены таблицы и построена диаграмма в h,s-координатах, на основании чего и проводятся расчеты процессов изменения состояния водяного пара.
Дата добавления: 2015-02-23; просмотров: 1088;
