Основные термодинамические функции
Если рабочее тело поместить в среду, имеющую постоянные температуру Т и давление р, то по истечении некоторого времени в рабочем теле по всему объему установятся такие же температура и давление, что и в среде. Указанный процесс изменения состояния рабочего тела называют термодинамическим процессом. До тех пор, пока состояние среды не изменится, параметры рабочего тела также не будут меняться. Рабочее тело будет находиться в так называемом термодинамическом равновесии со средой. В неравновесном состоянии параметры по объему рабочего тела будут различны. Следовательно, только в состоянии термодинамического равновесия параметры будут определять состояние всего рабочего тела.
Любое физическое тело, в частности рабочее тело, обладает внутренней энергией. Количество ее не является постоянным. В термодинамике под внутренней энергией рабочего тела понимается сумма всех составляющих энергии тела. Сюда входят кинетическая энергия поступательного движения молекул, кинетическая энергия вращательного движения молекул, энергия колебательного движения атомов в молекуле, потенциальная энергия взаимодействия молекул. Первые три вида энергии можно объединить одним названием: кинетическая составляющая внутренней энергии, а последнюю назвать потенциальной составляющей. Кинетическая составляющая является функцией только температуры. Потенциальная составляющая, кроме температуры, зависит также от удельного объема, так как зависит от расстояния между молекулами газа. Поскольку в общем случае внутренняя энергия газа является функцией двух основных параметров, а каждому состоянию соответствует вполне определенное их значение, то, следовательно, для каждого состояния газа будет характерна своя однозначная, вполне определенная величина внутренней энергии U, т.е. иначе говоря, U – это также функция состояния газа, и разность внутренних энергий для двух каких-либо состояний рабочего тела или системы тел не будет зависеть от того, каким путем рабочее тело или система тел будет переходить из первого состояния во второе. Полную внутреннюю энергию тела принято обозначать буквой U (Дж), а удельную внутреннюю энергию, отнесенную к 1 кг, u ( 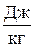 ). Математически разность внутренних энергий для двух состояний рабочего тела вычисляется так:
). Математически разность внутренних энергий для двух состояний рабочего тела вычисляется так:
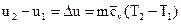 ,
,
где  обычно называют изменением внутренней энергии, единица измерения которой, отнесенная к 1 кг газа, будет
обычно называют изменением внутренней энергии, единица измерения которой, отнесенная к 1 кг газа, будет 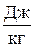 ; T1 и Т2 – начальная и конечная температуры в процессе;
; T1 и Т2 – начальная и конечная температуры в процессе;  – средняя удельная изохорная теплоемкость.
– средняя удельная изохорная теплоемкость.
В идеальном газе силы сцепления между молекулами отсутствуют, следовательно, нет и потенциальной энергии, которая обусловлена наличием сил сцепления. Поэтому для идеального газа внутренняя энергия представляет собой функцию только температуры газа и только ею и определяется.
При взаимодействии с другими телами внутренняя энергия рабочего тела может уменьшаться или увеличиваться. Это взаимодействие проявляется в двух формах: в форме теплоты путем теплообмена и в форме механической работы. В случае теплообмена теплота может подводиться из внешней среды к рабочему телу или отводиться от него во внешнюю среду, и необходимым условием передачи энергии является наличие разности температур между рабочим телом и средой. Энергия, отведенная в форме тепла (отведенное тепло), считается отрицательной, а энергия, подведенная в форме тепла (подведенное тепло), – положительной. Все тепло, отведенное или подведенное от рабочего тела обозначается Q (Дж), а отнесенное к 1 кг рабочего тела – q( 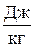 ). В первом случае внутренняя энергия рабочего тела уменьшается, во втором – увеличивается.
). В первом случае внутренняя энергия рабочего тела уменьшается, во втором – увеличивается.
Другой формой передачи энергии в термодинамическом процессе является работа. В отличие от тепла передача энергии в этой форме обязательно связана с видимым перемещением тела (в целом или отельных его частей) и, в частности, с изменением его объема.
Энергию, подведенную к рабочему телу в форме работы, принято называть совершенной над телом работой и считать ее отрицательной. Отведенную энергию в форме работы называют затраченной телом работой и считают ее положительной. Полная работа обозначается буквой L (Дж), а удельная – l ( 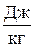 ).
).
Важно отметить, что при различных условиях протекания процесса соотношение между теплом и работой будет различно, даже если начальные и конечные состояния в процессах будут совпадать. Отсюда следует, что тепло и работа зависят от пути процесса и в отличие от внутренней энергии не являются функциями состояния, а представляют собой функции процесса. Для графического определения работы удобно пользоваться диаграммой, на которой по оси абсцисс откладывают значение удельного объема газа v в процессе, а по оси ординат – устанавливающееся при этом давление. Если получившиеся на этой диаграмме отдельные точки, каждая из которых характеризует состояние газа, соединить между собой плавной кривой, то получится линия, характеризующая изменение состояния газа. Тогда полная работа расширения или сжатия газа L будет определяться площадью под кривой. Удельная работа газа при его расширении:
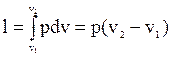 .
.
Систем осей координат, называемая p,v-диаграммой или индикаторной диаграммой, широко используемой в термодинамике для анализа различных процессов изменения состояния газов. Если при изменении состояния газа объем его уменьшается, т.е. совершается сжатие, то при подсчете работа получается отрицательной, так как начальный объем в этом случае будет больше конечного. Физический смысл отрицательной работы состоит в том, что работу совершают внешние силы, приложенные к газу, а не сам газ.
Внутренняя энергия U характеризует энергетическое состояние частиц, составляющих рабочее тело. Однако для анализа всех термодинамических процессов этого понятия недостаточно, так как необходим параметр, характеризующий потенциальную энергию связи данного рабочего тела с окружающей средой. Таким параметром является энтальпия H:
H=U+pV.
Из аналитического определения энтальпии следует, что она складывается из внутренней энергии рабочего тела и величины pV, которая представляет собой работу, затраченную на то, чтобы ввести тело объемом V в окружающую среду с давлением р.
Энтальпия, как и внутренняя энергия, имеет в каждом определенном состоянии, т.е. при определенных параметрах, вполне конкретное и единственное значение, следовательно, энтальпия является функцией состояния, и ее изменение в каком-либо термодинамическом процессе зависит только от параметров тела в начале и конце процесса и не зависит от характера самого процесса. Поскольку в технической термодинамике приходится иметь дело только с изменением энтальпии, то отсчет ее производится от условного нуля. Обозначается энтальпия для произвольного количества рабочего тела буквой H (Дж), а для 1 кг – букой h ( 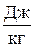 ). Для 1 кг рабочего тела энтальпия
). Для 1 кг рабочего тела энтальпия
h = u + pv.
В теплотехнических расчетах и исследованиях широкое использование получила функция состояния, называемая энтропией от греческого слова tropos (превращение или преобразование). Такое название свидетельствует о том, что эта функция используется для исследования процессов преобразования энергии. Из всей подведенной в круговом процессе теплового двигателя теплоты Q1 в полезную работу переводится только часть ее, а именно  . Теплота же Q2, передаваемая в теплоприемник, является необходимой потерей, которую, однако, следует стремиться уменьшать. Значение тепловой потери согласно выражению для к.п.д. прямого обратимого цикла зависит от: отношения Q1/T1 и термодинамической температуры T2. Температура теплоприемника T2 изменяется обычно в небольших пределах, поэтому теплота Q2 зависит, главным образом, от отношения Q1/T1: чем оно больше, тем больше потеря теплоты. Отношение Q/T называется приведенной теплотой или энтропией. В термодинамических расчетах представляет интерес не абсолютное значение энтропии, а лишь ее изменение в процессе, которое зависит только от конечного и начального состояний рабочего тела. Для бесконечно малого участка процесса приведенное тепло примет вид
. Теплота же Q2, передаваемая в теплоприемник, является необходимой потерей, которую, однако, следует стремиться уменьшать. Значение тепловой потери согласно выражению для к.п.д. прямого обратимого цикла зависит от: отношения Q1/T1 и термодинамической температуры T2. Температура теплоприемника T2 изменяется обычно в небольших пределах, поэтому теплота Q2 зависит, главным образом, от отношения Q1/T1: чем оно больше, тем больше потеря теплоты. Отношение Q/T называется приведенной теплотой или энтропией. В термодинамических расчетах представляет интерес не абсолютное значение энтропии, а лишь ее изменение в процессе, которое зависит только от конечного и начального состояний рабочего тела. Для бесконечно малого участка процесса приведенное тепло примет вид  .
.
Изменение энтропии газа в процессе 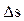 и сама энтропия s не зависят от характера процесса изменения состояния газа, а определяются только начальным и конечным состояниями рабочего тела, т.е. энтропия s действительно является функцией состояния. Единицей измерения удельной энтропии служит единица
и сама энтропия s не зависят от характера процесса изменения состояния газа, а определяются только начальным и конечным состояниями рабочего тела, т.е. энтропия s действительно является функцией состояния. Единицей измерения удельной энтропии служит единица 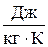 . Так как удельная энтропия является параметром состояния, то она может быть использована для графического изображения термодинамических процессов в так называемой T,s-диаграмме или тепловой диаграмме, по одной из осей которых откладываются значения удельной энтропии, а по другой оси термодинамической температуры Т. Если линия процесса идет вправо, что указывает на рост, то теплота к рабочему телу подводится. Если же линия процесса идет влево и энтропия уменьшается, то теплота отводится.
. Так как удельная энтропия является параметром состояния, то она может быть использована для графического изображения термодинамических процессов в так называемой T,s-диаграмме или тепловой диаграмме, по одной из осей которых откладываются значения удельной энтропии, а по другой оси термодинамической температуры Т. Если линия процесса идет вправо, что указывает на рост, то теплота к рабочему телу подводится. Если же линия процесса идет влево и энтропия уменьшается, то теплота отводится.
Дата добавления: 2015-02-23; просмотров: 2058;
