Кинетика процессов горения
Кинетика горения – это учение о скорости и механизме химических реакций при сгорании топлив.
Под горением понимают быстропротекающее химическое превращение, сопровождающееся выделением значительного количества тепла и обычно ярким свечением (пламенем).
В общем случае при горении происходит образование новых молекул или перераспределение химических связей между молекулами, участвующими в реакции. Такой процесс возможен, если топливо имеет состав, несущественно отличающийся от стехиометрического и реагирующие элементы находятся в непосредственном соприкосновении. Следовательно, необходимым условием осуществления окислительно-восстановительной реакции является столкновение реагирующих молекул. Согласно молекулярно-кинетической теории газов, каждая молекула за счет хаотического теплового движения испытывает 109 столкновений в секунду. Если бы при каждом соударении молекулы реагировали между собой, то любая реакция протекала бы мгновенно. Этого мы не наблюдаем на практике.
| E1 |
| E2 |
| E |
| E0 |
| Еисх |
| Q |
|
| 2СО + О2=2СО2+ Q |
| 3.1. Изменение энергии при горении окиси углерода |
В исходном состоянии средняя энергия всех частиц, находящаяся в реагирующей системе, – Eисх. При подведении энергии в каком-либо объеме системы и доведение ее до уровня Е1 начнется химическая реакция, которая затем пойдет самопроизвольно с выделением теплоты, при этом энергетический уровень продуктов реакции понизится до Е2. Здесь количество выделенной теплоты Q = Eисх – Е2. Превышение энергии Е1 над Еисх обозначают Е0, измеряют в Дж/кг и называют э н е р г и е й а к т и –
в а ц и и.
Для моля энергия активации обозначается 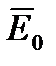 и измеряется в Дж/моль
и измеряется в Дж/моль
Энергия активации, это избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к началу химической реакции.
Величина энергии активации зависит от структуры молекул, температуры реагирующих компонентов. Определяют ее экспериментально. Молекулы, обладающие энергией Е1 = Еисх + Е0, называют активными молекулами или активными комплексами. Активный комплекс – это неустойчивое промежуточное состояние химических элементов (связи разорваны) с большим запасом энергии. Чем больше активных молекул в реагирующей смеси, тем более интенсивно, с большей скоростью будут протекать химические реакции.
Под скоростью химической реакции понимают количество молей вещества, прореагировавшее в единице объема в единицу времени.
Весьма сильное влияние на скорость реакции оказывает температура смеси. С ростом температуры увеличивается интенсивность взаимных соударений реагирующих молекул, что способствует росту скорости реакции. Например, для некоторых реакций увеличение температуры всего на 10° приводит к возрастанию скорости в 2…4 раза.
В связи с этим скорость химической реакции будет определяться концентрацией молекул, их температурой и энергией активации.
Согласно теории Вант - Гоффа и Аррениуса, формула скорости химической реакции имеет вид:
W = к0  (3.1)
(3.1)
где W – скорость химической реакции;
к0 – характерная для исследуемой реакции константа;
cB, cD – концентрации исходных продуктов реакции;
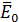 – энергия активации;
– энергия активации;
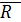 – универсальная газовая постоянная;
– универсальная газовая постоянная;
Т – температура.
Выражение (3.1) показывает, что зависимость скорости химической реакции от температуры носит экспоненциональный характер.
Химическая реакция горения в большинстве случаев является сложной, т.е. состоит из большего числа элементарных химических процессов. Кроме того, химические превращения при горении связаны с рядом физических процессов (переносом тепла и масс) и характеризуются соответствующими гидро и газодинамическими закономерностями. В силу комплексной природы горения суммарная скорость горения практически никогда не тождественная скорости чисто химического взаимодействия.
Характерная черта горения – способность к пространственному распространению. Это объясняется либо диффузией активных частиц в топливной смеси, либо образованием новых активных центров вследствие подвода энергии в форме теплоты из зон химических реакций. В первом случае говорят о диффузионном, а во втором – о тепловом механизме распространения пламени.
Для любого вида горения характерны две типичные стадии – воспламенение и последующее сгорание (догорание) топлива. Время, затраченное на обе стадии, составляет общее время горения. Обеспечение минимального суммарного времени горения при максимальном тепловыделении является основной задачей техники сжигания.
Различают гомогенное и гетерогенное горение. При гомогенном горении горючее и окислитель подаются в одинаковых агрегатных состояниях, при гетерогенном – в разных.
Дата добавления: 2015-02-16; просмотров: 4188;
