Воспламенение топлив
Горению предшествует процесс воспламенения топливной смеси. Процесс воспламенения может быть либо в ы н у ж д е н н ы м, либо а в т о - н о м н ы м (самовоспламенение).
При вынужденном воспламенении для начала реакций горения используется внешний источник энергии (искра электрической свечи, раскаленные продукты сгорания какого-либо топлива и т.д.). В топливной смеси, находящейся в непосредственной близости от источника зажигания, создается местное повышение температуры и накопление активных частиц. Если этого активизирующего воздействия будет достаточно для увеличения скорости реакции в смеси, то смесь в этом месте воспламеняется, и далее пламя будет распространяться от источника воспламенения по всему объему.
При автономном воспламенении необходимость в постороннем источнике энергии отпадает. Здесь реакции горения начинаются за счет химической активности при соединении компонентов даже при низких температурах. Это приводит к повышению температуры и накоплению активных частиц, и если смесь горючего и окислителя будет однородна, то воспламенение произойдет во всем объеме. В реальных случаях вследствие неидеальности перемешивания компонентов топлива смесь по объему является неоднородной: в одних областях отсутствует окислитель, в других – горючее. Есть и области, в которых состав смеси оказывается наиболее благоприятным для самовоспламенения. Здесь и появляются первые очаги горения. По мере увеличения температуры и накопления активных частиц вокруг этих очагов пламя распространяется на весь объем.
Сам процесс воспламенения в зависимости от причины увеличения скорости реакции может носить характер т е п л о в о г о или цепного воспламенения.
Если основной причиной резкого возрастания скорости реакции является разогрев смеси, то воспламенение называется тепловым. Если же заметного роста температуры не наблюдается, а основной причиной резкого увеличения скорости реакции является накопление активных радикалов и атомов, то воспламенение называется ц е п н ы м.
В случае воспламенения должно пройти некоторое время с момента впуска смеси в сосуд до резкого повышения температуры и давления. За это время происходит подготовка смеси к сгоранию: повышается температура, накапливаются активные промежуточные продукты сгорания.
Промежуток времени, в течение которого смесь становится способной к воспламенению, называется периодом индукции, или задержкой воспламенения.
Период индукции обозначают τi. Он зависит от химического состава, температуры, давления смеси, размеров сосуда. Величина τi может составлять от 10-3 с до нескольких секунд.
Наиболее благоприятным для воспламенения является стехиометрическое соотношение горючего и окислителя. Еслисостав смеси далек от стехиометрического, то воспламенение затруднено. Максимальная и минимальная величины соотношений компонентов, при которых еще возможно воспламенение, называются верхним и нижним концентрационными пределами воспламенения.
Температурой воспламенения называется минимальная температура смеси при стехиометрическом соотношении, когда возможно тепловое или цепное воспламенение.
Таким образом, для реакции воспламенения в рассматриваемом пространстве, смесь должна представлять собой гомогенную газообразную фазу, состоящую из элементов горючего и окислителя с достаточной энергией активации и в соотношении между нижним и верхним концентрационными пределами.
3.2.1. Тепловое воспламенение
Сущность воспламенения состоит в том, что за счет источника тепла или за счет экзотермических реакций, протекающих в самой горючей смеси, смесь разогревается до некоторой температуры, и далее происходит ее воспламенение во всем объеме одновременно.
Рассмотрим воспламенение горючей смеси, находящейся в некотором сосуде, за счет экзотермической реакции. Количество тепла, выделяющегося в сосуде в единицу времени 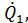 зависит от скорости химической реакции и может быть определено по формуле
зависит от скорости химической реакции и может быть определено по формуле
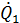 =
= 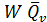 , (3.2)
, (3.2)
где W – скорость химической реакции;
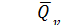 мольный тепловой эффект реакции.
мольный тепловой эффект реакции.
Эта зависимость представлена на рис. 3.2 Выделяемая в результате реакции теплота разогревает горючую смесь, следовательно , увеличивается теплоотдача к стенкам сосуда, Тепловой поток к стенкам 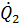 определяется по выражению
определяется по выражению
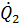 = α (Т – Тст) F , (3.3)
= α (Т – Тст) F , (3.3)
где α – коэффициент теплоотдачи от горючей смеси к стенкам сосуда;
Т, Тст – температуры смеси и стенок сосуда;
F – площадь поверхности сосуда.
Из уравнений (3.2) и (3.3) следует, что с изменением температуры скорость тепловыделения изменяется по экспоненте, а скорость теплоотвода по линейному закону. В зависимости от температуры стенки и давления сме-
 сиси взаимное расположение линий, определяемых уравнениями (3.2) и (2.3),
(2.3 может быть различным (рис. 3.2). Так, при температуре стенки Т׳ ст ли-ии пернии пересекаются в двух точках, при темтемпературе стенки Т ׳׳ст линии касаются др друг друга в одной точке.
Рас Рассмотрим первый случай взаимногного расположения линий. При температуртуре смеси Т< Т1 тепловыделение болбольше теплоотвода, и за счет этого пропроисходит разогрев смеси до некоторой температуры Т1. Нагрев смеси до большей температуры произойти не может, так как тептеплоотвод превышает тепловыделение. СоСостояние системы в области температур тур до Т1 характеризуется незначитель-ныным нагревом горючей смеси и малой 3.2. Зависимость теплоподвода и
скскоростью реакции. Воспламенения нет. теплоотвода от температуры топ- сиси взаимное расположение линий, определяемых уравнениями (3.2) и (2.3),
(2.3 может быть различным (рис. 3.2). Так, при температуре стенки Т׳ ст ли-ии пернии пересекаются в двух точках, при темтемпературе стенки Т ׳׳ст линии касаются др друг друга в одной точке.
Рас Рассмотрим первый случай взаимногного расположения линий. При температуртуре смеси Т< Т1 тепловыделение болбольше теплоотвода, и за счет этого пропроисходит разогрев смеси до некоторой температуры Т1. Нагрев смеси до большей температуры произойти не может, так как тептеплоотвод превышает тепловыделение. СоСостояние системы в области температур тур до Т1 характеризуется незначитель-ныным нагревом горючей смеси и малой 3.2. Зависимость теплоподвода и
скскоростью реакции. Воспламенения нет. теплоотвода от температуры топ-
|
Состояние системы в точке 2 характерно ливной смеси
тем, что небольшое повышение темпера-
туры системы относительно ее значения в точке 2 вызывает ускоренный саморазогрев смеси до воспламенения с последующим быстрым сгоранием. Понижение температуры системы (менее значения в точке 2) переместит систему в состояние 1. Увеличивая температуру стенки сосуда до некоторого значения Т׳׳, можно создать условия, при которых скорости теплоотвода и тепловыделения будут равными (точка 3). Режим, соответствующий этой точке, будет устойчивым как при понижении температуры, так и при ее повышении. Такое состояние системы называют критическим.
В случае высокой температуры стенки (например 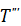 ) воспламенение устойчиво.
) воспламенение устойчиво.
Явление самовоспламенения горючей смеси при критическом состоянии носит название теплового воспламенения. Теория теплового воспламенения разработана академиком Н.Н. Семеновым. В этой теории доказано, что температура самовоспламенения не является физической константой горючей смеси, а зависит от свойств смеси, характера теплообмена между горючей смесью и внешней средой, от теплопроводности материала стенок сосуда, температуры внешней среды и ряда других факторов.
3.2.2. Цепное воспламенение
Сущность цепного воспламенения заключается в том, что при определенных условиях в топливной смеси образуются активные центры, вызывающие цепной механизм протекания химической реакции. Теория цепного воспламенения разработана отечественными учеными.
Согласно этой теории, химический процесс протекает с несколькими промежуточными стадиями. Активная частица при каждом элементарном химическом взаимодействии порождает одну или даже две другие активные частицы, которые при следующих столкновениях порождают, в свою очередь, новые активные частицы.
Активной частицей служит не молекула, обладающая большой кинетической энергией, а частица с ненасыщенной валентностью. Такими частицами являются свободные радикалы (например, гидроксильная группа) или атомы. Продукты промежуточных стадий (активные частицы) неустойчивы, и их реакция с исходными веществами и между собой происходит легче и быстрее. Реакции, имеющие такой механизм, называются цепными. Если в результате соударения активной частицы образуется только одна новая активная частица, то цепная реакция называется неразветвленной; при образовании двух новых активных частиц цепная реакция будет разветвленной, лавинообразной.
Примером неразветвленной цепной реакции может служить процесс образования хлористого водорода. Процесс осуществляется путем последовательных чередований реакций атомарных хлора и водорода, регенерирующих друг друга:
Cl2 + H → HCl + Cl или H2 + Cl → HCl + H.
В результате этих взаимодействий образуется не только конечный продукт реакции – хлористый водород, но и новая активная частица – атом водорода или хлора. При следующем столкновении атома одного вещества с молекулой другого вещества процесс повторяется.
Реакция продолжается до гибели самого активного центра или до так называемого обрыва цепи. Обрыв цепи может произойти в результате рекомбинации атомов, соединения их с инертными примесями и по другим причинам.
Скорость неразветвленной реакции сначала резко возрастает до некоторой максимально возможной величины при данной температуре, а затем уменьшается, приближаясь к нулю. Первоначальный рост скорости связан с увеличением концентрации активных центров, последующее ее уменьшение обусловлено обрывом цепи.
Ярким примером разветвленной цепной реакции служит горение водородо – кислородного топлива. Схема развития разветвленной цепи реакций для таких компонентов имеет вид:
Из приведенной схемы видно, что атом водорода, положив начало цепной реакции, в ходе реакции вновь регенерируется и вызывает затем рождение нескольких атомов. Таким образом, цепь разветвляется, и создаются условия для образования лавины активных центров, что ведет к саморазгону реакции, вплоть до воспламенения.
В некоторых случаях цепные разветвления происходят не в результате взаимодействия активной частицы с молекулой исходного вещества, а в результате распада молекул промежуточных продуктов на радикалы.
Горение углеводородов также представляет собой цепную реакцию, причем, чем сложнее строение углеводородов, тем большее количество элементарных реакций составляет цепь. Цепные реакции горения углеводородов оказываются слабо разветвленными и поэтому протекают относительно медленно. Реакция горения чистого водорода сильно разветвлена и может протекать взрывообразно.
Дата добавления: 2015-02-16; просмотров: 2800;
