Тучные клетки (мастоциты) и базофилы.
Тучные клетки (мастоциты) и базофилы представляют тканевые клетки, содержащие в цитоплазме базофильные гранулы. Оба типа клеток имеют костномозговое происхождение и принадлежат к миелоидному ряду, завершают развитие в тканях. В отличие от базофилов, относящихся к клеткам крови, тучные клетки не циркулируют в крови и представляют тканевые оседлые клетки. Базофилы могут полностью созревать в костном мозге. Тучные клетки из костного мозга, продолжая созревание, мигрируют в селезенку, а затем в кровь и далее в ткани (в наибольшем количестве — в слизистую оболочку кишечника) – таблица 6.
Мастоциты реагируют на разного рода повреждающие воздействия, участвуют в развитии воспаления, служат основными эффекторными клетками при гиперчувствительности немедленного типа и входят в первую линию иммунной защиты, обеспечивая в первую очередь защиту от многоклеточных паразитов.
Предшественники тучных клеток, циркулирующие в крови, не похожи на свое потомство. На этой стадии они имеют морфологию моноцитов. Обычные места их локализации – зоны вокруг сосудов, нервов, протоков желез, а также субсерозные и субмукозные слои различных оболочек. Популяция тучных клеток неоднородна. На основе наличия в клетках триптазы и химазы выделяют: мастоциты, содержащие оба фермента (ТКтх – кожа, подслизистый слой кишечника, соединительная ткань – серозные - IgE-зависимая и IgE-независимая активация, участвуют в развитии процесса склерозирования) и только триптазу (ТКт – легкие и слизистая кишечника - мукозные - IgE-зависимая активация, участвуют в развитии реакций на инвазию паразитов и аллергических реакций).
Таблица 6.
Краткая характеристика базофилов и тучных клеток
| Базофилы | Тучные клетки | |
| Происхождение | Красный костный мозг | |
| Место созревания | Красный костный мозг | Соединительная ткань |
| Присутствие в циркуляции | Да | Нет |
| Способность к размножению | Отсутствует | Присутствует |
| Длительность жизни | Дни | недели, месяцы |
| Экспрессия рецептора к IgE (иммуноглобулин, повышающийся при протозойной инфекции и аллергии) | ||
| Гистамин | + | + |
| Гепарин | ? | + |
Базофилы также могут выполнять аналогичные функции, так как имеют рецепторы к IgЕ. Однако если тучные клетки, находясь в очагах повреждения, реагируют на него немедленно, вовлечение базофилов в подобные реакции требует их миграции в ткани, что исключает участие базофилов в инициации и осуществлении ранних этапов реакций врожденного иммунитета.
Дендритные клетки.Основная часть дендритных клеток является ближайшим родственником макрофагов. Но они не просто поглощают чужеродный материал, но перерабатывают его до информационного состояния, выделяя антигенные детерминанты, вызывающие активацию Т-лимфоцитов.
Для зрелых дендритных клеток характерны 3 фундаментальных свойства, объединяющие все их разновидности:
- отростчатая, древовидная морфология в тканях и наличие псевдоподий и ворсинок (вуалевые клетки) в циркуляции и культуре клеток;
- высокая экспрессия зрелыми клетками молекул МНС не только I, но и II класса в сочетании с костимулирующими молекулами (CD80, CD86);
- способность захватывать (путем пиноцитоза и, в меньшей степени, фагоцитоза) и обрабатывать антиген с последующим его представлением Т-лимфоцитам, что вызывает активацию последних.
По происхождению делятся на миелоидные и лимфоидные (плазмацитоидные). Миелоидные дендритные клетки и макрофаги имеют общего предшественника. В тканях они дифференцируются в интерстициальные дендритные клетки, клетки Лангерганса и макрофаги. Клетки Лангерганса имеют ряд существенных особенностей, отличающих их от других дендритных клеток. Прежде всего это присутствие в цитоплазме слоистых включений — гранул Бирбека. На поверхности клеток Лангерганса присутствует лектиновый рецептор - лангерин и «неклассическая» молекула МНС — CD1a, предназначенная для презентации липидных антигенов. Лангерин присутствует уже на циркулирующих предшественниках этих клеток.
Лимфоидные дендритные клетки происходят из лимфоидного ростка. Преобладающая разновидность циркулирующих в крови незрелых дендритных клеток — плазмоцитоидные дендритные клетки, относящиеся к лимфоидному ряду. Плазмоцитоидные дендритные клетки меньше моноцитов (8–10 мкм), а их ядро имеет менее выраженную выемку. В присутствии IL-3 и бактериальных продуктов они дифференцируются в зрелые лимфоидные дендритные клетки. В отличие от предшественников миелоидных дендритных клеток, попадающих в лимфатические узлы с афферентной лимфой, плазмоцитоидные дендритные клетки проникают в лимфатические узлы тем же путем, что и Т-лимфоциты — через высокий эндотелий посткапиллярных венул. При стимуляции (вирусами или IL-3) плазмоцитоидные дендритные клетки в течение первых суток интенсивно секретируют интерфероны I типа, а затем в течение вторых суток дифференцируются в зрелые лимфоидные дендритные клетки. При стимуляции вирусами созревающая дендритная клетка способствует дифференцировке Т-клеток-продуцентов IFNγ (Th1-клеток).
В условиях воспаления дендритные клетки барьерных тканей интенсивно поглощают (путем пино- или фагоцитоза) окружающий материал, в том числе чужеродные продукты; активируются патогенами («образами патогенности» — PAMP, представленными на поверхности патогенов) и подвергаются действию провоспалительных цитокинов. Под влиянием этих стимулов незрелые дендритные клетки покидают ткани и с тканевой жидкостью через лимфатические сосуды поступают в региональные лимфатические узлы. В процессе миграции происходит созревание дендритных клеток: их способность к эндоцитозу значительно ослабевает; они осуществляют переработку поглощенного материала и встраивают пептидные фрагменты белков в молекулы MHC.
Поглощение и расщепление чужого могут осуществлять многие клетки, но дендритные клетки делают щадящую переработку с выделением антигена.
 |

|
|

|
|


|
|
Рис. 14. Эндосомальный путь переработки бактерии, захваченной из вне.
Возможно два пути переработки антигена: экзогенный (эндосомальный) и эндогенный (протеосомальный). В первом случае антиген захватывается из вне. Наработанные антигенные пептиды взаимодействуют с присутствующим здесь же МНС II, а затем доставляются на поверхность клетки (рис. 14).
В ряде случаев, если извне захвачен вирус, антигены презентируются и в составе MHC I. Механизм называется «кросс-презентация» (рис. 15).
Второй (протеосомальный) путь деструкции антигена направлен преимущественно на переработку и презентацию собственных и вирусных антигенов (в случае заражения клетки) протеинов (рис. 16). Эндогенные пептиды доставляются в эндоплазматический ретикулум, где вступают в контакт с МНС I. Далее транспортируются к наружной мембране.



|
|




|
|
|


|
|

Рис. 15. Эндосомальный путь переработки вируса, захваченного из вне.
|
|



|
|


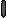
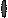
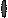
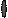

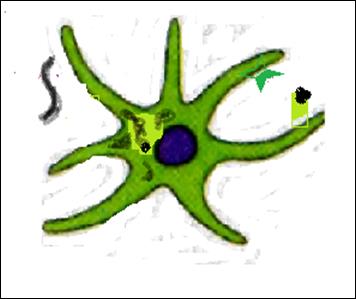
Рис.16. Протеосомальный путь переработки вируса, инфицировавшего дендритную клетку.
Схематически можно указать:
А) объект презентации располагается вне дендритной клетки:
1) эндосомальное поглощение бактерий приводит к выведению АГ в МНС II дендритной клетки;
2) эндосомальное поглощение свободного вируса – АГ вируса и в MHC I и MHC II дендритной клетки.
Б) объект презентации располагается внутри дендритной клетки
1) протеосомальная переработка белков вируса внутри инфицированной дендритной клетки приводит к выведению АГ вируса в MHC I.
Отдельное место занимают фолликулярные дендритные клетки. Захватывают антиген в рамках иммунного комплекса и презентирующие В-лимфоцитам памяти.
В итоге, наиболее значимой функцией дендритной клетки является презентация антигена. Дендритная клетка наиболее эффективный презентер, но выделяют и ряд других (схема 7).
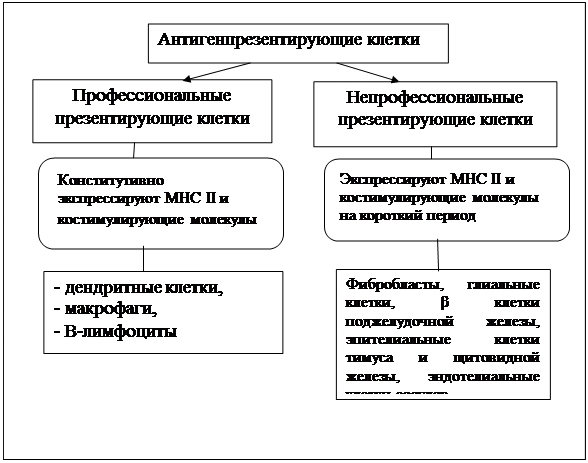 |
Схема 7. Виды антигенпрезентирующих клеток.
Лимфоциты врожденного иммунитета (ILC (innate lymphoid cells)).Данные клетки особенно существенны для 1-й линии защиты в барьерных органах и входят в состав МАЛТ. ILC также важны для развития лимфоидной ткани, регуляции циркуляции Т- лимфоцитов, В-лимфоцитов и дендритных клеток, гомеостаза эпителия слизистых оболочек, заживления ран и др.
На сегодняшний день выделяют несколько основных клеток данной группы:
- cNK - цитотоксические натуральные киллеры (функция: перфорин-опосредованный антителозависимый цитолиз),
- regNK - регуляторные натуральные киллеры (синтез интерферона γ, перфорин-опосредованный цитолиз),
- LTi–клетки – (lymphoid tissue inducer cells) – клетки – индукторы лимфоидной ткани, ассоциированной со слизистыми - развитие лимфоидной ткани в эмбриогенезе, кишечный гомеостаз, защита от внеклеточных патогенов,
- тимические NK-клетки (синтез интерферона γ, защита от вирусов,
внутриклеточных, патогенов, опухолей),
-NH (ILC2 (nuocytes, natural helper cells) - натуральные хелперы – за счет IL-5 стимулируют B1 лимфоциты к переходу в плазматические клетки, спонтанно синтезирующие IgA, через синтез амфирегулина обеспечивает протекцию эпителия на фоне вирусной инфекции.
Естественные (натуральные) киллеры (Natural killers – NK-клетки)наиболее изученные лимфоциты врождённого иммунитета. Крупные клетки с азурофильной зернистость в цитоплазме (несут на мембране CD56, отсутствуют СD3 рецепторы, характерные для классических Т-лимфоцитов и иммуноглобулиновые – В-лимфоцитов), способны распознавать и убивать собственные видоизменные клетки.
NK имеют общего лимфоидного предшественника с Т- и В-лимфоцитами. Зрелые клетки мигрируют в периферические лимфоидные органы, кишечник, печень, легкие, матку. Существует две субпопуляции: CD16+ и CD16-. CD16+ – осуществляют антителозависимую цитотоксичность – лизируют связанные антителами клетки, содержат перфорин.
NK не имеют антигенраспознающих рецепторов. Гранулы содержат: перфорины, гранзимы и гранулолизины. В основном проявляют цитотоксичность в отношении измененных (вирусозараженных, опухолевых) клеток организма. Секретируют ряд цитокинов, в первую очередь – интерферона γ (данный процесс активизируется при взаимодействии с макрофагами). Значительная часть находится в циркуляции - 10-15%, также в синусоидах печени, матки. Сохраняют активность – 7-10 суток.
Принцип действия. Если естественные киллеры не находят на клетках МНСI класса, то запускается механизм контактного цитолиза (концепция «утраты своего»). Киллерная активность распространяется только на клетки, не имеющие или утратившие идентичность с естественным киллером. Разрушение мишеней происходит двумя путями: через выброс гранул и на основе рецепторных сигналов, запускающих апоптоз.
Контактный цитолиз:
1. Распознавание мишени при отсутствии собственного рецептора (МНС I) и контакт (синапс).
2. Активация киллера (выброс перфорина – образование трансмембранного канала в клетки без своего МНСI, а затем доставка гранзима, который направляет клетку по апоптотическому пути).
3. Программирование гибели может происходит без участия цитолитических гранул с помощью FasL-взаимодействия (параллельный или альтернативный механизм запуска апоптоза).
4. Уничтожение клетки-мишени (клетка-киллер не погибает).
Цитотоксический механизм реализуется в течение 30-90 минут. NK способен уничтожить большее количество инфицированных вирусом клеток, чем опухолевых.
На сегодняшний день описан феномен формирования NK-клеток памяти (G. Min-O, et al, 2013). Они могут быть вирус-индуцированными (ЦМВ, герпес вирус и др.) – локализация в печени и селезенки, гаптен-индуцированными (проникающие через кожу) – локализация: печень, кожа и цитокин-индуцированными (IL-12, IL-18, продуцируемые макрофагами) - локализация: органы повреждения).
Вопросы для самоконтроля.
1. Дайте общую характеристику эозинофилов, базофилов и тучных клеток.
2. Охарактеризуйте особенности развития, морфология, миграции, секреторной активности эозинофилов.
3. Тучные клетки (мастоциты) и базофилы. Общая характеристика, особенности созревания, миграции, разновидности.
4. Раскройте особенности презентации антигена миелоидными дендритными клетками (эндосомальный и протеосомальный пути).
5. Назовите основные лимфоциты врожденного иммунитета, указав их происхождение, механизмы распознавания мишени, функции.
Дата добавления: 2015-02-16; просмотров: 5684;
