Кроветворные стволовые клетки и миелопоэз.
Кроветворение происходит в красном костном мозге (центральном органе иммунной системы). Все клетки крови происходят от гемопоэтической стволовой клетки, которая несет на мембране CD34 и ряд других рецепторов. При этом деление стволовых клеток происходит достаточно медленно (1 раз в 30-60 суток). Жизнеспособность и направление развития поддерживают стромальные клетки костного мозга, а также присутствующие в микроокружении цитокины (эндогенные пептиды, медиаторы межклеточного взаимодействия). Дифференцируясь, стволовые клетки дают начало двум основным ветвям: миелоидной и лимфоидной. При этом гемопоэзу свойственна пластичность, которая во многом поддерживается именно цитокинами.
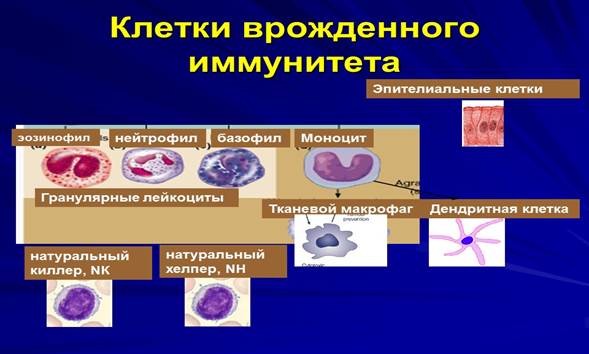
Рис. 7. Основные клетки врожденного иммунитета.
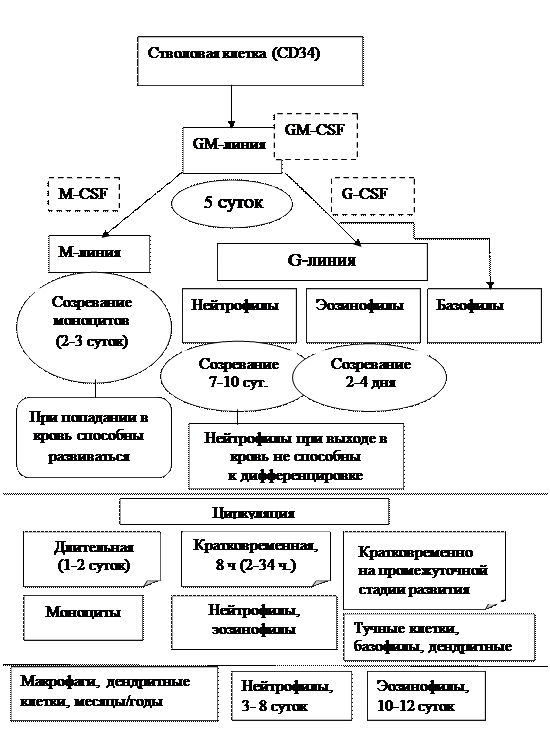
Развитие клеток врожденного иммунитета идет по трем линиям: базовая – гранулоцитарно-марофагальная (цитокин, сопровождающий данное направление - гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-GSF)) с последующим делением на моноцитарную и гранулоцитарную – схема 3. Между появлением гранулоцитарно-макрофагального предшественника и его дифференцировкой на моноцитарно-макрофагальный (цитокин - моноцитарно-макрофагальный фактор (M-CSF)) и гранулоцитарный предшественник (гранулоцитарный фактор - G-CSF) проходит около 5 суток – это один из самых длительных периодов миелопоэза. Следующий этап – созревание – значительно отличается для моноцитов и гранулоцитов. Моноциты -1-3 суток, нейтрофилы – 10-14 суток, эозинофилы – 2-4 дня. После созревания моноциты находятся еще сутки в костном мозге, нейтрофилы -1-2 дня и затем покидают его, поступая в кровоток. При этом моноциты сохраняют способность к делению и дальнейшей дифференцировки. Нейтрофилы выходят в кровь клеткой неспособной к делению, индуцированной экспрессии рецепторов, синтезу белка.
Все клетки проходят стадию циркуляции в крови:
1. Одни клетки (дендритные и тучные) циркулируют столь кратковременно и в малом количестве (промежуточная стадия развития), что при обычном определении лейкоцитарной формулы их выделит невозможно.
Схема 3.
    |
Другие клетки (нейтрофилы, моноциты) представляют основной пул лейкоцитов крови. Все разновидности миелоидных клеток спонтанно мигрируют из крови в ткани, где одни быстро погибают (нейтрофилы) или длительно функционируют, проникая в качестве резидентных клеток практически во все органы и ткани, изменяя при этом под влиянием микроокружения свои морфофункциональные особенности (так к тканевым формам моноцитов относятся макрофаги и миелоидные дендритные клетки). Кровоток служит депо, из которого клетки также могут экстренно мигрировать в очаг развивающегося воспаления.
Таким образом, участие миелоидных клеток в обеспечение врожденного иммунитета складывается из экстренной реакции клеток, мобилизуемых из кровотока при воспалении, и постоянной (фоновой)деятельности резидентных клеток. Нейтрофилы, эозинофилы и базофилы мобилизуются из крови в ткани в основном в экстренных случаях, а моноциты/макрофаги, наоборот, преимущественно играют роль клеток, длительно живущих и функционирующих в различных тканях. Производительность гранулоцитопоэза по сравнению с моноцитопоэзом значительно выражение. За сутки образуется и поступает в кровь 1011 нейтрофилов (100 г), столько же погибает. Производительность моноцитопоэза в 20 раз ниже. Существует еще две разновидности миелоидных клеток – дендритные и тучные. Они циркулируют в крови на промежуточной стадии развития и планово мигрируют в ткани.
Нейтрофилы – нейтрофильные сегментоядерные лейкоциты, нейтрофильные гранулоциты – основная часть белых клеток крови. Нейтрофилы являются первой линией клеточной защиты.
Это профессиональные охотники за микробами, обладающие самой высокой подвижностью среди всех клеток организма. Они первыми (в течение 30 мин) приходят в очаг воспаления, где проявляют разнообразные виды активности: захватывают и поглощают чужеродные объекты, реализуют комплекс бактерицидных эффектов, продуцируют хемотаксины и медиаторы, регулирующие активность других клеток. Их доля среди лейкоцитов крови здоровых людей может составлять 35-75% (у взрослых обычно 2/3 от их общего числа). Они легко распознаются под микроскопом по наличию сегментированного - 3-5 сегментов - ядра и содержанию в цитоплазме небольших по размеру гранул. Некоторые CD-рецепторы: CD13 – рецептор для распознавания ряда вирусов, CD 14 – рецептор для липополисахарида (компонент клеточной стенки грамотрицательных бактерий)
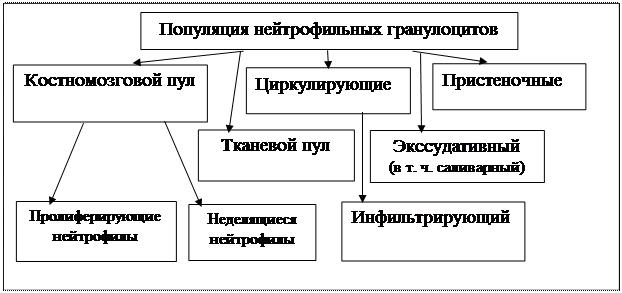 |
Схема 4. Популяции нейтрофильных гранулоцитов (Нестерова И. В., 2014)
Развитие нейтрофилов. Жизненный цикл занимает около 14 дней, большая часть которого проходит в красном костном мозге. Выделяют:
1) митотическую;
2) постмитотическую фазы.
Митотическая фаза (7,5 дней) характеризуется несколькими циклами деления. Образование нейтрофилов начинается с дифференцировки стволовой клетки в миелобласт, промиелоцит. Далее происходит процесс формирования азурофильных гранул, содержащих миелопероксидазу, эластазу, дефензины (первичные гранулы). Позднее, на стадии миелоцита, появляются гранулы (лактоферрин и лизоцим) – вторичные гранулы. Наличие готовых микробиоцидных веществ в гранулах избавляет нейтрофил от необходимости запуска целого ряда синтетических процессов в период воспалительной мобилизации, что значительно повышает скорость его эффективного реагирования. Такой же способностью (иметь готовые биоактивные вещества) обладают базофилы, эозинофилы, тучные клетки, NK-клетки.
Постмитотическая фаза (примерно 6,5 дней) - нейтрофил прекращает делиться. В этот период наблюдается существенная перестройка ядерного аппарата. Происходит конденсация хроматина с последующей сегментацией ядра, в связи, с чем полиморфноядерный лейкоцит становится неспособным к делению. Наличие сегментированного ядра позволяет нейтрофилам проникать через мелкие поры (3-5 мкм в диаметре; для моноцитов, имеющих почкообразное ядро, этот барьер в 2 раза выше - 8 мкм).
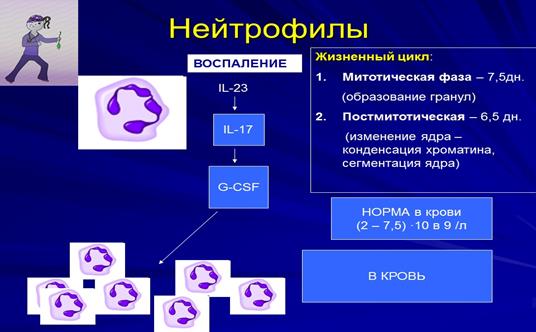
Рис 8. Особенности размножения нейтрофилов.
Развитие нейтрофилов контролируют цитокины, из которых главную роль играют - гранулоцитарный колониестимулирующий фактор (G-CSF), а вспомогательную IL-3 и IL-6. Повышение содержания нейтрофилов в условиях воспаления регулируется цитокинами: IL -17 и IL– 23. IL-23 индуцирует образование IL-17, который в свою очередь выработку G-CSF. При стимуляции образами патогенности активация постмитотического пула мгновенно (в первую очередь пристеночных нейтрофильных гранулоцитов, а затем костномозговой резерв), через 2-3 дня повышение гранулопоэза – рис. 8.
Большая часть зрелых нейтрофилов не покидает костный мозге и погибает. Это происходит через включение механизмов апоптоза (программной гибели клетки) с последующей элиминацией клеточного материала костномозговыми макрофагами. Лишь небольшая доля образовавшихся нейтрофилов поступает в кровоток. Эти клетки, несмотря на отсутствие внешних отличий от дифференцированных нейтрофилов костного мозга, обладают многократно большим фагоцитозным потенциалом. Время их присутствия в циркуляции менее 1 дня (период полувыведения составляет 6-7 часов). Они элиминируются из кровотока макрофагами печени и селезенки.
В норме в крови (2,0 – 7,5) на 109/л. В кровотоке только 1-2% зрелых нейтрофилов. После физического напряжения (тяжелая работа, занятия спортом, роды, эпилептический припадок) количество нейтрофилов в крови может существенно увеличиваться. Это обусловлено как повышенным поступлением морфологически зрелых нейтрофилов из костного мозга (эффект связан с влиянием кортикостероидных гормонов надпочечников), так и уменьшением адгезивности лейкоцитов крови, расположенных вдоль эндотелия сосудов, и их переходом в циркулирующий пул (действие адреналина). В дальнейшем нейтрофилы могут поступать в мышцы. В таких ситуациях они выступают в роли питающих клеток, доставляя гликогена энергетически обедненным тканям.
Нейтрофилы в крови: а) пристеночные (маргинальные), скорость кровотока выше, чем скорость их передвижения, б) свободные. Пристеночные нейтрофилы катятся как «мячи по тротуарной плитке». При этом скорость кровотока выше скорости движения нейтрофилов.
Основная функция нейтрофилов - защита организма от локальных бактериальных инфекций. Для ее реализации ему необходимо проникнуть из кровяного русла в ткань.
При развитии местной воспалительной реакции в тканях повышается провоспалительные цитокины, а в прилегающих сосудах на этом фоне повышается проницаемость для нейтрофилов (за счет изменения рецепторов эндотелиальных клеток сосудистой стенки). Важно отметить, что миграция в кровь нейтрофилов происходит с участием адгезинов (β-интегрины, Р- и Е-селектины), фермента эластаза, которые секретируют сами нейтрофилы. Значимым является способность нейтрофилов активно продуцировать IL-12 и через него регулировать презентацию антигена дендритными клетками и макрофагами, пролиферацию естественных киллеров и синтез интерферона γ, активность Т-лимфоцитов (особенно Th1).
Мобилизация нейтрофила включает 3 стадии:
- роллинг (качение за счет наличия селектинов на мембране нейтрофилов),
- адгезия (прикрепление с остановкой на фоне повышения в тканях IL-8, который стимулирует образование на эндотелии сосудов и нейтрофилов интегринов)
- диапедез (прохождение между эндотелиальными клетками сосуда – нейтрофил образует псевдоподию, и она проникает между эндотелиоцитами. Нейтрофил вскрывает эндотелиальную застежку. Достигнув базальной мембраны, нейтрофил секретирует эластазу, коллагеназу, расщипляя волокна соединительной ткани и расчищая себе путь для дальнейшего проникновения) – рис. 9.
Хемотаксис – направленное движение по градиенту концентрации веществ, которые повышаются при воспалении (хемоаттрактанты) и к которым у нейтрофила есть рецепторы.
Нейтрофил за пределами кровеносного русла меняют морфологию. Это уже не «катящийся шар», а распластанная клетка, ползущая в направлении эпицентра воспаления. В очаге воспаление нейтрофил находится в окружении множества хемоаттрактантов (N-формилметионилпептид – бактериальный пептид, С5а- продукт расщепления компонента системы комплемента, IL-8-цитокин). Таким образом, нейтрофилы, обладая рецепторами к хемоаттрактантам, способны воспринимать изменения окружающей среды и реагировать на них. Эти рецепторы родственны родопсиновым рецепторам органа зрения.
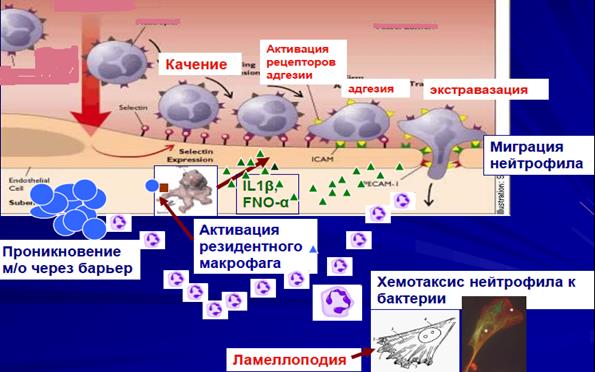
Рис 9. Эмиграция и хемотаксис нейтрофилов.
Проводя аналогию, можно сказать, что нейтрофил, подобно глазу, «видит» воспалительный очаг, который притягивает его как «свет ночную бабочку» (Черешнев В.А., Шмагель К.В., 2013). Далее следуют этапы классического фагоцитоза.
Нейтрофил может уничтожать микроорганизмы:
а) путем поглощения чужого (наиболее эффективно) и воздействуя биоактивными веществами;
б) секретируя свои гранулы за пределы клетки (когда размер объекта фагоцитоза превышает возможности нейтрофила, сопровождается деструкцией тканей).
Наименее эффективное действие нейтрофила – цитолиз с излитием в окружающую среду внутреннего содержимого. Такое происходит в условиях недостаточности опсонинов, грибковых поражениях. Клинически – это проявляется бактериальным гнойным отделяемым (светло-зеленый цвет гною придает миелопероксидаза). При этом большое количество гноя отражает высокий мобилизационный потенциал нейтрофилов, но с недостаточной бактерицидной функцией.
в) за счет образования нейтрофильных внеклеточных ловушек (НВЛ, англ. neutrophil extracellular traps - NETs) - структуры, состоящие из деконденсированного хроматина и антимикробных факторов (нейтрофильная эластаза, миелопероксидаза и др.), высвобождаемых нейтрофилами. В ловушках захватываются и уничтожаются бактерии, грибки и паразиты; их формирование происходит путем ранее неизвестного вида клеточной смерти, отличного от некроза и апоптоза.
Нейтрофилы после разрушения бактериальной клетки подвергаются апоптозу. На их мембранах появляются рецепторы для распознавания и последующего поглощения макрофагами. Макрофаги при этом выполняют одну из основных своих функций – удаление погибших своих клеток.
В норме нейтрофилы не активируются в кровеносном русле, что происходит при септических состояниях. Если бактерия в крови, то нейтрофил дегранулируется прямо в кровотоке, и это приводит к диссеминированному внутрисосудистому свертыванию, грозному осложнению, сопровождающемуся нарушением свертывающей системы крови. Активированные нейтрофилы образуют лейкоагрегаты, которые оседают в капиллярах малого круга кровообращения и вызывают отек легких. Вероятно, риск подобных процессов и определяет короткий период нахождения нейтрофила в крови (1 сутки).
Моноциты.Система мононуклеарных фагоцитов представлена в организме макрофагами и дендритными клетками, которые присутствуют в различных органах и тканях, имеющих общего предшественника и способных выполнять ряд функций:
1) фагоцитоз чужеродного и эндогенного материала;
2) пиноцитоз макромолекул;
3) участие в процессах регенерации
4) презентация антигенов Т- и В-лимфоцитам
5) секреция биологически активных веществ.
Схематически можно указать: если макрофаги через рецепторы распознали погибающее «свое» запускается противовоспалительный механизм, если же через образы патогенности «чужого», то синтезируются провоспалительные цитокины.
Развитие макрофагов. Макрофаги и основная часть дендритных клеток формируются из гранулоцитарно-макрофагальной линии. Моноциты покидают костный мозг и поступают в кровь. Здесь их доля – 2-9% (500×106/л). В течение суток клетки могут находится в циркуляции, а затем либо поступают в ткани, переходя в макрофаги, либо - апоптоз. Моноциты способны к дифференцировке (отличие от нейтрофилов). Макрофаги значительно крупнее моноцитов и имеют распластанную форму. Имеют огромное разнообразие рецепторов. Все разновидности Toll-подобных рецепторов.
Моноцит в костном мозге – 2 суток (нейтрофил – 2 недели), способен к размножению и дальнейшей дифференцировки. В крови – моноцит, в тканях – макрофаг.
Макрофаги делятся на: 1) фиксированные – макрофаги различных органов и тканей (таблица 5).
Таблица 5.
| Орган | Вид макрофага |
| Печень | Купферовские клетки |
| Легкие | Альвеолярные макрофаги |
| Перитонеальная полость | Перитонеальные макрофаги |
| Кожа | Эпидермальные и дермальные макрофаги |
| Почки | Мезангиальные клетки |
| Костная ткань | Остеокласты |
| Соединительная ткань | Гистиоциты |
| Нервная система | Микроглиальные клетки |
| Плацента | Клетки Хофбауза |
Функции фиксированных макрофагов:
1) контроль процессов клеточного роста;
2) детоксикация;
3) удаление отмирающих тканевых клеток – основная функция!!!!! Общий объем ежедневного перерабатываемого макрофагами трупного материала огромен.
4) очищение кровотока от деградирующего материала, сгустков фибрина, обмен липидов, железа.
Ведущая роль в очищении кровотока принадлежит печеночным макрофагам. Очищение организма имеет выраженный противовоспалительный характер. Макрофаг, поглотивший вступившую в апоптоз клетку, синтезирует противовоспалительные цитокины. Глюкокортикостероиды так же стимулируют поглощение макрофагами эндогенного «мусора», что приводит к завершения воспалительного процесса.
Кроме фиксированных макрофагов, существуют: 2) мигрирующие при развитии воспаления из кровеносного русла (моноциты-макрофаги). Моноцит, попавший в зону воспаления – делится и дифференцируется в «воспалительный» макрофаг. Эти макрофаги в первую очередь способны к фагоцитозу и менее зависимы от опсонизации объекта. В очаг воспаления приходят позднее нейтрофилов (на 6 часов). Причины позднего выхода из кровотока: во-первых - клетки эндотелия позднее начинают синтезировать рецепторы для взаимодействия именно с макрофагами. Во-вторых, ядро моноцита замедляет прохождения между эндотелиоцитами. Моноцитов меньше в крови, и они медленнее двигаются в тканях. Нейтрофилы в очаге воспаления со временем начинают синтезировать вещества, блокирующие миграцию других нейтрофилов, но активизирующие моноциты (липоксины). Если макрофаги через рецепторы распознали погибающее «свое» запускается противовоспалительный механизм, если же через образы патогенности «чужого», то синтезируются провоспалительные цитокины.
Рецепторы на поверхности фагоцитов:
1- рецепторы к С3b-компоненту комплемента – СR3b: за счет химического сродства связывают через С3b (опсонин) липополисахариды грамотрицательных микробов, липопротеиды простейших, поверхностные структуры грибов;
2- рецепторы для связывания маннозы (лектина) на поверхности сальмонелл, микобактерий и др. клеток;
3- рецепторы для Fc-фрагментов IgG – через IgG (опсонин) адсорбция различных чужеродных клеток;
4- скавенджер – рецепторы для производных лигандов сиаловых кислот, находящихся на клетках (деградирующие и погибающие собственные клетки) – это рецепторы для «уборки мусора» (“scavenger receptor”).
Классическая активация макрофагов происходит под воздействием IFN-γ, TNFα. Альтернативная активация под действием IL-4 приводит к преобладанию иммуносупрессорной активности у клетки. За счет этого возможно формирование полярных эффектов на уровне одной клетки: воспалительно-бактерицидных, сменяющихся на регенеративно-противовоспалительных. В очаге острого воспаления процессы чередуются (рис. 10).
|
|
Рис. 10. Изменение функциональной активности макрофагов.
Фагоцитоз. Под фагоцитозом понимают поглощение клеткой частиц размером более 0,5 мкм. Как уже отмечалось, явление фагоцитоза было открыто И.И. Мечниковым (1882), за это ученый был удостоен Нобелевской премии. В настоящее время роль фагоцитоза в организме многоклеточных рассматривают шире: участие в морфогенезе, элиминации клеток, погибающих по механизму апоптоза и т.д.
1. Эмиграция и хемотаксис лейкоцитов.
При развитии воспаления под воздействие провоспалительных факторов попадают клетки эндотелия мелких сосудов. В качестве медиаторов при этом прежде всего выступают цитокины, секретируемые макрофагами – IL-1, TNF-α. Эндотелиальные клетки конститутивно экспрессируют рецепторы для этих цитокинов. Взаимодействие между рецепторами клеток эндотелия и лейкоцитов – основа эмиграции из кровеносного русла. Схематически процесс осуществляется в 4 стадии:
1. Качение – 1-5 секунд
2. Активация рецепторов интеграции – 20 секунд
3. Адгезия. Прочное взаимодействие – лейкоцит останавливается – несколько минут
4. Экстравазация. Продвижение лейкоцита между эндотелиальными клетками
2. Хемотаксис – направленное движение лейкоцита к чужеродному объекту. Обязательное условие движения градиент хемотаксических веществ. В основе движения лейкоцитов лежит реакция сокращающихся белков цитоскелета под влиянием хемоаттрактантов. Клетка из округлой становится треугольной. В сторону объекта хемотаксиса выдвигается ламеллоподий – участок цитоплазмы, бедный органеллами, но содержит микрофиламенты (актин). При этом клетка секретирует эластазу, коллагеназу, что способствует преодолению базальных мембран вокруг сосудов и под эпителиальным пластом, а также других преград. Как известно, раньше других клеток в очаг воспаления попадают нейтрофилы, существенно позже макрофаги. Скорость движения 1 мм/ч. Хемотаксис можно рассматривать как дистантное взаимодействие с фагоцита и его объекта.

Рис 11. Основные стадии фагоцитоза.
2. Адгезия - начальный этап поглощения объекта фагоцитом. Обязательное условие адгезии распознавание объекта фагоцитоза. Механизмы распознавания разнообразны и принципиально различаются в случаях фагоцитоза опсонизированного и неопсонизированного объекта. В отсутствии опсонизации молекулярное распознавание, необходимое для прилипания фагоцита к клеткам- мишеням, осуществляется в основном двумя группами рецепторов. Одна группа – scavenger-рецепторы («мусорщики»), физиологически предназначенные для выведения липопротеинов низкой плотности (вредные для организма, способствуют развитию атеросклероза) и способные распознавать липидные компоненты бактерий (грамотрицательные, микобактерии и др.). Вторая группа рецепторов выводит погибшие клетки. Важно, что без опсонизации идет малый процесс фагоцитоза. Распознавание фагоцитом предварительно опсонизированных клеток более типично для инфекционного процесса. Под опсонизацией понимают обволакивание частицы молекулами, облегчающими ее распознавание и поглощение фагоцитом. Это собственные вещества организма, являющиеся «мостиком» между мембранными рецепторами фагоцитирующих клеток и поверхностными структурами бактерий. Существует два основных варианта опсонизации в зависимости от вещества-посредника:
1)Ig G;
2)Инактивированный iС3 компонента комплимента рис. 12.
Часто оба фактора опсонизируют клетку одновременно.
Рецепторы для распознавания опсонинов:
1. Fcγ-рецепторы для Fc-фрагментов IgG;
2. CR1, CR3 рецепторы к С3b-компоненту комплемента.
| |



|


|





|

|
|

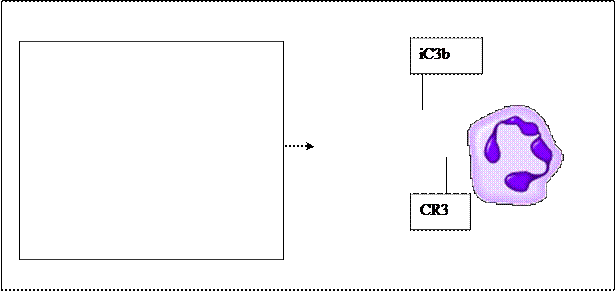 Рис. 12. Активации опсонина - C3b компонента комплемента для повышения эффективности фагоцитоза.
Рис. 12. Активации опсонина - C3b компонента комплемента для повышения эффективности фагоцитоза.
3. Активация мембраны.
Формирование фагоцитарной чаши. На мембране фагоцита, контактирующей с микроорганизмом, образуется – фагоцитарная чаша. Далее поляризуется актин в мембране фагоцита. Нити актина окружают основание фагоцитарной чаши – схема 6.

 |  |  | |||
Схема 6. Стадии поглощения при фагоцитозе (длительность 2 минуты).
4. Формирование и созревание фагосомы.
Погружение частицы обусловлено сокращением нитей актина, сконцентрированных вокруг чаши. Фагосома – опсонизированная бактерия или частица, окруженная клеточной мембраной. Сразу после образования фагосома не несет бактерицидных веществ. Перемещаясь внутрь клетки, фагосома созревает, сливаясь с гранулами фагоцита. Решающий этап созревания – слияние с лизосомами и образование фаголизосомы.
5. Затем происходит разрушение объекта фагоцитоза. Существуют кислородзависимые, оксидазотзавимые и кислород- и оксидазотнезависимые механизмы уничтожения чужого.
1) Кислородзависимые факторы:
-активные формы кислорода,
- галоидсодержащие соединения.
2) Азотистые метаболиты.
Кислород- и оксидазота-независимые факторы
- Локальное закисление
- Бактерицидные пептиды (дефензимы, кателицидины)
- Катионные белки
- Ферменты (лизоцим)
- Конкурентные ингибиторы метаболизма (лактоферрин)
Кислородзависимая цитотоксичность фагоцитов играет ведущую роль в деструкции объекта фагоцитоза. Этот процесс получил название метаболического (дыхательного, респираторного, кислородного) взрыва. При этом потребление кислорода фагоцитом может увеличиться в течение нескольких секунд во много раз. В результате дыхательного взрыва образуются цитотоксичные метаболиты кислорода (так называемые активные формы кислорода), свободные радикалы и перекисные продукты органических и неорганических соединений. В последующих реакциях может трансформироваться в другие активные формы: синглетный кислород, гидроксильный радикал (ОН-), пероксид водорода. Последний процесс катализирует супероксиддисмутаза.
По разнообразию антимикробных факторов макрофаг слабее нейтрофила, но он способен одномоментно производить активные формы кислорода и метаболиты азота в больших концентрация.
*Начиная с 12-18 недели гестации активность фагоцитоза по мере развития плода возрастает и к рождению количественные характеристики соответствуют взрослому человеку, но качественно является не зрелым. Поглотительная активность достаточно развита, но завершающая стадия формируется только к 6 месяцам. Уровни лизоцима, лактоферрина, миелоперексидазы, участвующие в завершающей стадии снижены. У детей первого месяца жизни не подвергаются фагоцитозу пневмококки, клебсиеллы, гемофильная палочка, а стафилококки и гонококки даже размножаются внутри фагоцитов.
6. Заключительный этап фагоцитоза – выброс содержимого фагосомы путем дегрануляции.
Различают:
1. Завершенный фагоцитоз, когда поглощение заканчивается полным разрушением чужеродных частиц;
2. Незавершенный фагоцитоз, когда поглощенные частицы сохраняются в фагосомах.
Персистирование связано с тремя основными механизмами:
1) блокада фаголизосомального слияния (вирусы, микобактерии, простейшие).
2) резистентность к лизосомальным ферментам (гонококки, стафилококки)
3) способность м/о покидать фагосомы после поглощения и сохраняться в цитоплазме (риккетсии).
Дата добавления: 2015-02-16; просмотров: 5881;

