Электрод Раствор
+ -
+ -
+ -
+ -
+ -
Так как А = µi (Ме+р-р) - µi (Ме+тв.), где µi (Ме+тв.) = постоянная величина, а µi (Ме+р-р) зависит от активности ионов металла в растворе:
µi (Ме+р-р) = µiо(Ме+р-р) + RT×ln ai,
где ai – активность ионов металла в растворе, ai = Сi × gi;
где gi -коэффициент активности ионов в растворе;
µi о = µi – при стационарных условиях.
Тогда мы имеем: nFЕ = µi о (Ме+р-р) + RT×ln ai - µi (Ме+тв.)
Откуда: 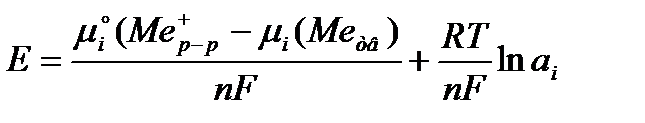
Обозначим 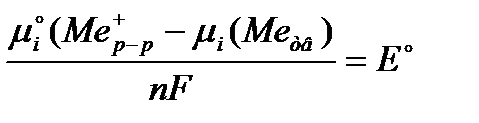 ,
,
Тогда окончательно: 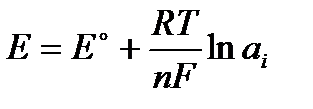
Получено уравнение, которое связывает электродный потенциал с активностью ионов металла в растворе.
Соответствующий вывод был сделан Нернстом, но в формуле Нернста вместо активности взята концентрация.
Если принять аi = Сi, то формула 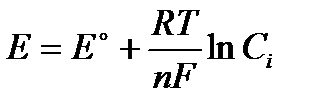 действительна для очень разбавленных или идеальных растворов.
действительна для очень разбавленных или идеальных растворов.
Контактные потенциалы уже учтены в стандартных потенциалах металлов. В связи с этим нужно всегда помнить, что в случае металлов их стандартные потенциалы представляют собой не дей ствительные относительные значения электродных потенциалов (т.е. разности потенциалов на границе электрод/раствор), а фактически алгебраическую сумму электродного потенциала и контактного потенциала между данным металлом и платиной.
Практически при электролизе в электролите возникает так называемый диффузный потенциал. Концентрация ионов электролита в катодном и анодном пространствах изменяется, в результате чего между образующимися вновь растворами возникает добавочная разность потенциалов. Причина – невозможно избежать процесса диффузии ионов.
Этот диффузионный потенциал считается по различным формулам для различных случаев.
1. Одинаковые электролиты, но различных концентраций:
Едифф. = 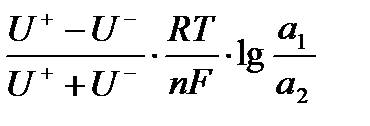 , если U+ > U-
, если U+ > U-
Едифф. =  , если U- > U+.
, если U- > U+.
2. Различные электролиты, но одинаковых концентраций с общим ионом:
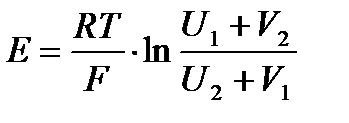
Поэтому, когда невозможно избежать процессов диффузии, необходимо обязательно учитывать диффузионный потенциал.
Электродный потенциал металла, погруженного в раствор, содержащий ионы того же металла, вычисляется по уравнению Нернста:
для 180С множитель 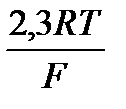 = 0,058, поэтому
= 0,058, поэтому 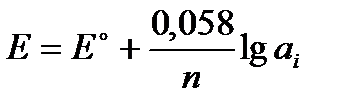
где Е - электродный потенциал металла;
Е0 – нормальный электродный потенциал металла, т.е. разность потенциалов между металлом и раствором, в котором концентрация ионов равна 1моль/л.
n – число электронов, который теряет атом металла (равно валентности металла в данном растворе).
Электродвижущая сила гальванического элемента вычисляется по формуле:
e = E1-E2
e = (E10 + 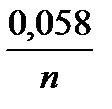 . lg a1) – (E20 +
. lg a1) – (E20 + 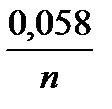 . lg a2).
. lg a2).
Если n1 = n2, то e = E10 - E20 + 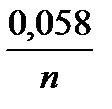 . lg
. lg 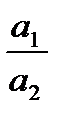 ,
,
Активность a = C . g, где g- коэффициент активности металла в растворе (найти в справочнике).
Дата добавления: 2015-02-16; просмотров: 892;
