Требования, предъявляемые к работе.
Составить гальванический элемент и методом компенсации измерить ЭДС при разных концентрациях электролитов:
1) Zn ½ ZnSO4 ½½KCl ½½ CuSO4 ½ Cu
0,1N 1N 0,1N
2) Ag, AgCl ½ KCl ½½ KCl ½½ CuSO4 ½ Cu
N 0,1N
3) Zn ½ ZnSO4 ½½ KCl ½½ KCl ½ AgCl, Ag
0,1N 1N
4) Ag, AgCl ½ KCl ½½ KCl ½½ CuSO4 ½ Cu
1N 1N
5) Zn ½ ZnSO4 ½½ KCl ½½ CuSO4 ½ Cu
0,1N 1N 1N
6) Zn ½ ZnSO4 ½½ KCl ½½ CuSO4 ½ Cu
1N 1N 1N
7) Zn ½ ZnSO4 ½½ KCl ½½ KCl ½ AgCl, Ag
1N 1N
8) Zn ½ ZnSO4 ½½ KCl ½½ CuSO4 ½ Cu
1N 1N 0,1N
(Ag, AgCl ½ KCl - хлорсеребряный электрод).
Полученные данные сопоставить с расчетными величинами по уравнению Нернста, указав % ошибок.
Данные эксперимента внести в таблицу:
| № п/п | Концентрация | ЭДС опытная | ЭДС по Нернсту | Ошибка, % | |
| ZnSO4 | CuSO4 | ||||
| . . |
Для расчета теоретических ЭДС все необходимые данные найти в справочнике физико-химических величин (нормальные потенциалы металлов, значения средних коэффициентов активности для растворов указанных концентраций, выраженных в моль/л).
Ошибка,% = 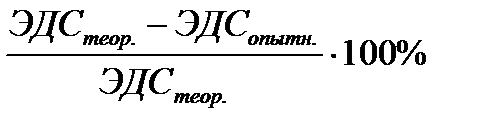
Вопросы к работе:
1. Классификация электрохимических цепей. Работа (механизм работы) концентрационных и химических цепей.
2. Диффузионный потенциал. Механизм его возникновения. Правила записи цепей и электродов.
3. Классификация электродов. Электроды 1, 2 рода.
Дата добавления: 2015-02-16; просмотров: 737;
