Цветные реакции на белки и аминокислоты
| Исследуемый материал | Окраска продукта | Реагирующая группа |
| Биуретовая реакция | ||
| Вода | ||
| Казеин | ||
| Яичный белок | ||
| Желатин | ||
| Аминокислота | ||
| Нингидриновая реакция | ||
| Вода | ||
| Казеин | ||
| Яичный белок | ||
| Желатин | ||
| Аминокислота | ||
| Ксантопротеиновая реакция | ||
| Казеин | ||
| Яичный белок | ||
| Желатин | ||
| Фенол | ||
| Реакция Фоля (на слабосвязанную серу) | ||
| Вода | ||
| Казеин | ||
| Яичный белок | ||
| Желатин |
НИНГИДРИНОВАЯ РЕАКЦИЯ. В этой реакции растворы белка, полипептидов, пептидов и свободных α-аминокислот при нагревании с нингидрином дают синее, сине-фиолетовое или розово-фиолетовое окрашивание. Окраска в этой реакции развивается за счет α-аминогруппы. Реакция протекает в две стадии.
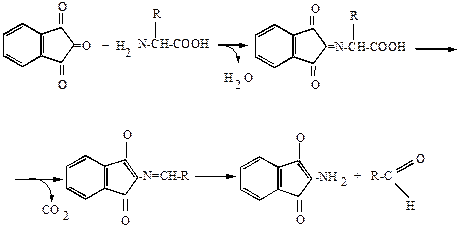 |
|
|
|
 |
|
|
|
|
Очень легко реагируют с нингидрином a-аминокислоты. Наряду с ними сине-фиолетовый Руэмана образуют также белки, пептиды, первичные амины, аммиак и некоторые другие соединения. Вторичные амины, например пролин и оксипролин, дают желтую окраску.
Нингидриновую реакцию широко используют для обнаружения и количественного определения аминокислот.
ХОД РАБОТЫ. Берут пять пробирок, и вносят по 1 мл: в первую воды, во вторую – раствора казеина, в третью – раствора яичного белка, в четвертую – раствора желатины, в пятую – раствора аминокислоты (глицина). Затем в каждую пробирку добавляют по 10-12 капель раствора с массовой долей нингидрина в ацетоне или этаноле 1 %. Содержимое каждой пробирки перемешивают встряхиванием и ставят их в кипящую водяную баню на 3-5 мин. Записывают химизм реакции, схему постановки опыта, строение окрашенных соединений. Результаты вносят в табл. 1.
КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ. Эта реакция указывает на наличие в белках остатков ароматических аминокислот – тирозина, фенилаланина, триптофана. Основана на нитровании бензольного кольца радикалов этих аминокислот с образованием нитросоединений, окрашенных в желтый цвет (греческое «Ксантос» – желтый). На примере тирозина эту реакцию можно описать в виде следующих уравнений.
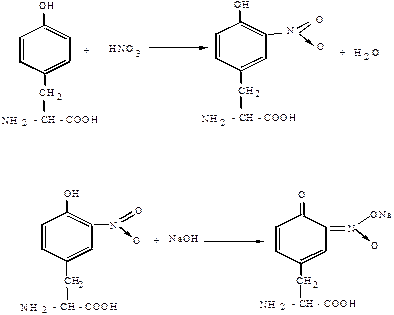 |
Тирозин Нитротирозин
|
В щелочной среде нитропроизводные аминокислот образуют соли хиноидной структуры, окрашенные в оранжевый цвет.
Ксантопротеиновую реакцию дают бензол и его гомологи, фенол и другие ароматические соединения.
ХОД РАБОТЫ. Берут четыре пробирки и вносят по 1 мл: в первую раствора казеина, во вторую – раствора яичного белка, в третью – раствора желатины, в четвертую – раствора фенола. Во все пробирки добавляют по 10 капель концентрированной азотной кислоты. Содержимое перемешивают встряхиванием и пробирки помещают в кипящую водяную баню на 5-8 мин. Под действием кислоты появляется осадок белка, который при нагревании окрашивается в желтый цвет. После бани пробирки выдерживают при комнатной температуре 4-5 мин и записывают окраску содержимого. Затем в каждую пробирку прибавляют по 1 мл раствора с массовой долей гидроксида натрия 30 % (или другую щелочь). Содержимое пробирок перемешивают встряхиванием, окраску записывают. Работу оформляют в соответствии с табл.1.
РЕАКЦИЯ ФОЛЯ (на слабосвязанную серу). Этой реакцией открывают в белках радикалы цистеина содержащие как свободные –SH (тиоловые) радикальные группы, так и окисленные с образованием дисульфидных (-S-S-) связей цистина.
При нагревании белка, содержащегося в молекуле остатки цистеина и цистина, с концентрированным раствором щелочи и ацетатом (или другой растворимой солью) свинца (реактив Фоля) образуется бурое или черное окрашивание. Это объясняют тем, что под действием щелочи от радикалов цистеина отщепляется сера в виде иона со степенью окисления минус два, который, взаимодействуя с ионом свинца (II), дает бурый или черный нерастворимый осадок сульфида свинца. Белки, в составе которых нет цистина и цистеина, реакцию Фоля не дают. Химизм процесса можно описать следующими реакциями:
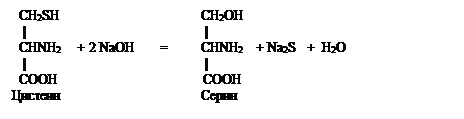 |
Na2S + Pb(CH3COO)2 = PbS + 2CH3COONa
Ацетат свинца Ацетат натрия
При нагревании со щелочью часть белка подвергается гидролизу. Кроме того происходит отщепление части аминогрупп (реакция дезаминирования) в виде аммиака, который можно обнаружить по запаху и посредством смоченной водой красной лакмусовой бумажки, поднесенной к отверстию пробирки (не касаться стенок!).
ХОД РАБОТЫ. Берут четыре пробирки и вносят по 1 мл: в первую воды, во вторую – раствора казеина, в третью – раствора яичного белка, в четвертую – раствора желатины. В каждую пробирку добавляют по 1 мл раствора с массовой долей гидроксида натрия 30 % и по 6-8 капель раствора с массовой долей ацетата свинца 5 %, или можно приготовить реактив Фоля на всю подгруппу и добавить по 1 мл в каждую пробирку приготовленного раствора. Содержимое перемешивают встряхиванием, и пробирки помещают в кипящую водяную баню на 5-7 мин. Окраску содержимого пробирок записывают. Результаты оформляют в табл. 1.
РЕАКТИВЫ.Вода дистиллированная (в дальнейшем вода); растворы с массовыми долями: казеина 1 %, желатины 1 %, яичного белка 1 %, сульфата меди 1 %, гидроксида натря 10 и 30 %, глицина (или другой аминокислоты) 0,1 %, фенола 0,1 %, ацетата свинца 5 %, нингидрина в ацетоне или этаноле 1 %; концентрированная азотная кислота.
Реактив Фоля готовят в пробирке перед определением. В пробирку вносят 1 мл 5 % раствора ацетата свинца и небольшими порциями (по 1,5-2 мл) приливают 30 % раствор гидроксида натрия с интервалом 30 сек, каждый раз, перемешивая, до растворения молочно-белого хлопьевидного осадка появившегося после внесения первой порции гидроксида натрия.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Общая характеристика пептидов, полипептидов, белков и их строения.
2. Как соединяются аминокислоты в молекуле белка и за счет каких групп? Соедините Ала, Цис, Сер.
3. Перечислите цветные реакции на белки и аминокислоты.
4. Какая реакция открывает пептидные связи? Её химизм.
5. Что характеризуют цвет и интенсивность окраски при положительной биуретовой реакции?
6. Что открывает нингидриновая реакция? Её химизм.
7. Назовите аминокислоты имеющие в радикале бензольное кольцо. Какой реакцией можно обнаружить ароматические аминокислоты? Её химизм.
8. Назовите аминокислоты содержащие серу. Какую из них обнаруживает реакция Фоля? Химизм реакции.
9. Какую цветную реакцию используют для количественного определения белков в растворе и почему?
10. Какую цветную реакцию используют для количественного определения α-аминокислот и почему?
Дата добавления: 2015-02-13; просмотров: 18545;
