Методы количественного определения белка
В настоящее время используют более десяти методов для определения массы белка в биологическом материале и продуктах питания, которые можно разделить на 3 группы: химические, физические и физико-химические (колориметрические).
Из химических наиболее часто применяют метод формольного титрования, метод кислотного титрования и универсальный - метод Кьельдаля, основанный на количественном определении азота в исследуемом биологическом материале или пищевом продукте.
Из колориметрических методов наиболее распространены количественное определение белка на основе биуретовой реакции и метод Лоури (основан на образовании окрашенных продуктов ароматических аминокислот с реактивом Фолина в сочетании с биуретовой реакцией), метод Бредфорда (основан на связывании белком красителя кумасси бриллиантового синего).
Среди физических методов наибольшее распространение получили: - рефрактометрический (по показателю преломления света раствором белка); - спектрофотометрический (по поглощению в ультрафиолетовой области спектра); - полярографический (по кривым зависимости между силой тока и напряжением, приложенным к системе, содержащей белок).
ОПРЕДЕЛЕНИЕ ОБЩЕГО АЗОТА ПО КЬЕЛЬДАЛЮ
Азот биологических объектов делят на общий, белковый и небелковый. Общий – это весь азот органических и минеральных соединений, содержащийся в биологическом объекте – целом организме, молоке, зернах растений, плодах и фруктах, яйцах птиц, мышцах, крови и т.п.
Белковый – это азот, входящий в состав белков. Небелковый – это азот, оставшийся в растворе после удаления белков. В составе небелкового азота различают: аминный (азот свободных аминокислот), амидный (азот аспарагина и глутамина), аммиачный азот, азот оснований, нитратный и нитритный азот.
Метод определения азота в биологических объектах и продуктах питания предложен Кьельдалем в 1883 году и до настоящего времени остается, по сравнению с другими методами, наиболее точным. Этим методом определяют отрицательно заряженный трехвалентный азот органических и минеральных соединений.
ПРИНЦИП МЕТОДА. Навеску анализируемого материала кипятят с концентрированной серной кислотой. При этом углерод органических веществ окисляется до диоксида углерода, водород – до воды; азот (отрицательно заряженный трехвалентный) превращается в аммиак, который с серной кислотой, взятой в избытке, образует сульфат аммония. Минерализованную пробу затем подщелачивают, аммиак отгоняют в раствор кислоты, где определяют титрованием.
Азот нитратов и нитритов, ядер гетероциклических соединений в ходе этого процесса в аммонийную соль не превращается.
ХОД РАБОТЫ. Работу по определению общего азота в биологических объектах и пищевых продуктах условно можно разделить на три этапа: минерализация, отгонка аммиака, титрование и расчет.
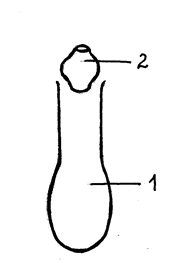
1. МИНЕРАЛИЗАЦИЯ. Материал для исследования взвешивают на аналитических весах с точностью до 0,0002 г и вносят, не касаясь краев, на дно колбы Кьельдаля (рис. 1) проба для анализа должна содержать 10-20 мг азота.
Исходя из этого отвешивают: сухой растительный материал – 300-500 мг, сухой животный материал – 100-200 мг, кровь, органы и ткани животных – 0,5-1,0 г, молоко – 2-4 г, молочная сыворотка – 10-20 г. В колбу добавляют 5-10 мл концентрированной серной кислоты (плотность 1,84), 5-7 крупинок сульфата меди (катализатор), 2-4 г сульфата калия или натрия (для повышения температуры кипения) и содержимое перемешивают круговым движением. Затем колбу ставят в наклонном положении на нагревательный прибор, помещенный в вытяжном шкафу, и закрывают ее отверстие стеклянной полой втулкой (специальный воздушный холодильник). Для уменьшения вспенивания и ускорения минерализации сразу же после начала нагрева в колбу осторожно добавляют 2-3 мл пероксида  водорода. В процессе сжигания пероксид водорода добавляется еще 2-3 раза, но перед этим колбу снимают с огня и выдерживают при комнатной температуре 3-5 мин. Минерализацию считают законченной, если содержимое колбы остается прозрачным при кипячении 10-15 мин после очередного добавления пероксида водорода.
водорода. В процессе сжигания пероксид водорода добавляется еще 2-3 раза, но перед этим колбу снимают с огня и выдерживают при комнатной температуре 3-5 мин. Минерализацию считают законченной, если содержимое колбы остается прозрачным при кипячении 10-15 мин после очередного добавления пероксида водорода.
 Параллельно с опытной ставят контрольную пробу с теми же реактивами, но без исследуемого материала. Химизм этого этапа можно выразить следующими уравнениями:
Параллельно с опытной ставят контрольную пробу с теми же реактивами, но без исследуемого материала. Химизм этого этапа можно выразить следующими уравнениями:
Навеска
биологического + H2SO4 ® CO2 +H2O + NH3.
материала
Образующиеся при минерализации диоксид углерода и вода улетучиваются, а аммиак вступает в реакцию с избытком серной кислоты:
2 NH3 +H2SO4 = (NH4)2 SO4.
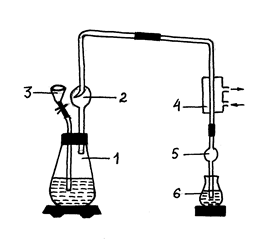
2. ОТГОНКА АММИАКА. Эту часть работы выполняют в отгонном аппарате (рис. 2), состоящем из перегонной колбы 1, насадки Кьельдаля 2, воронки со стеклянной трубкой 3, холодильника 4, трубки с шариком для предохранения от всасывания жидкости 5, приемного стакана или колбы 6.
По окончании минерализации колбу Кьельдаля с содержимым оставляют при комнатной температуре для охлаждения и собирают аппарат для отгонки аммиака. Затем в приемный стакан (или колбу) вносят 25 мл раствора с массовой концентрацией борной кислоты 4 % или 20 мл раствора с концентрацией серной кислоты 0,05 моль/л (или соляной = 0,1 моль/л), 3-5 капель смешанного индикатора (имеет резкий переход цвета при pH 5,4 от сине-фиолетового в кислой среде к зеленому в щелочной) и ставят его так, чтобы нижний конец трубки, присоединенной к холодильнику, был погружен в раствор кислоты приемной колбы.

 Охлажденный минерализат разбавляют в 2-3 раза водой и из колбы Кьельдаля переносят в перегонную колбу. Колбу Кьельдаля ополаскивают 3-4 раза порциями воды по 20-30 мл, смыв выливают в перегонную колбу. При ополаскивании учитывают, чтобы общий объем жидкости в перегонной колбе составлял около 1/3 ее вместимости. В перегонную колбу вносят 3-5 капель индикатора Таширо, бросают несколько кусочков пемзы или короткие стеклянные трубочки для равномерного кипения и ставят на нагревательный прибор. Все части отгонного аппарата соединяют герметически, через воронку приливают к содержимому перегонной колбы раствор с массовой долей гидроксида натрия 40 % до сильно щелочной реакции. При этом содержимое колбы окрасится в зеленый цвет. Нужный объем добавляемой щелочи можно предварительно рассчитать по реакции нейтрализации.
Охлажденный минерализат разбавляют в 2-3 раза водой и из колбы Кьельдаля переносят в перегонную колбу. Колбу Кьельдаля ополаскивают 3-4 раза порциями воды по 20-30 мл, смыв выливают в перегонную колбу. При ополаскивании учитывают, чтобы общий объем жидкости в перегонной колбе составлял около 1/3 ее вместимости. В перегонную колбу вносят 3-5 капель индикатора Таширо, бросают несколько кусочков пемзы или короткие стеклянные трубочки для равномерного кипения и ставят на нагревательный прибор. Все части отгонного аппарата соединяют герметически, через воронку приливают к содержимому перегонной колбы раствор с массовой долей гидроксида натрия 40 % до сильно щелочной реакции. При этом содержимое колбы окрасится в зеленый цвет. Нужный объем добавляемой щелочи можно предварительно рассчитать по реакции нейтрализации.
Включают холодильник и, нагревая содержимое перегонной колбы до кипения, отгоняют аммиак. Конец отгонки аммиака определяют по отсутствию изменения цвета красной лакмусовой бумажки при нанесении на нее капли жидкости, вытекающей из холодильника после отсоединения от него трубки с шариком. Первую проверку на полноту отгонки аммиака проводят через 10-15 мин после полного прогревания каплеуловителя. Обычно отгонку заканчивают после увеличения в приемной колбе объема жидкости в 2,5-3 раза от первоначального. По такой же методике производят отгонку содержимого контрольной колбы. Реакции второго этапа можно записать в виде следующих уравнений:
1. В перегонной колбе: (NH4)2 SO4 +NaOH = Nа2SO4 + NH3 + Н2O.
избыток
2. В приемной колбе:
а) при улавливании отгоняемого аммиака раствором серной кислоты -
2 NH3 +H2SO4 = (NH4)2 SO4,
б) при улавливании отгоняемого аммиака раствором борной кислоты - 2 NH3 + 4H3ВO3 = (NH4)2В4О7 + 5 Н2O.
Образовавшийся тетраборат аммония при гидролизе дает щелочную реакцию и содержимое приемной колбы окрашивается в зеленый цвет.
3. ТИТРОВАНИЕ И РАСЧЕТ. После окончания отгонки аммиака холодильник приподнимают так, чтобы свободный конец трубки с шариком находился над поверхностью жидкости приемной колбы и трубку изнутри и снаружи ополаскивают дистиллированной водой. Содержимое приемной колбы (погон) титруют раствором кислоты или щелочи, что зависит от соединения, применяемого для поглощения аммиака. При отгонке аммиака в раствор борной кислоты погон титруют раствором с концентрацией соляной кислоты 0,1 моль/л (серной кислоты 0,05 моль/л) до четкого перехода зеленого цвета в сине-фиолетовый (промежуточная окраска сероватого тона). Реакции, происходящие при титровании, можно описать следующими уравнениями:
(NH4)2В4О7 +2 HCl +5H2O = 2NH4Cl + 4Н3BO3
(NH4)2В4О7 +H2SO4 +5H2O = (NH4)2 SO4 + 4Н3BO3
Из приведенных уравнений легко рассчитать, что 1 мл раствора с концентрацией соляной кислоты 0,1 моль/л (серной кислоты 0,05 моль/л) соответствует 0,0014 г азота.
Массовую долю азота в исследуемом материале (Х, %) рассчитывают по формуле:
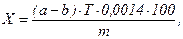
где а – объем раствора с концентрацией соляной кислоты 0,1 моль/л (серной кислоты = 0,05 моль/л), израсходованной на титрование опытной пробы, мл;
b – объем раствора той же кислоты, израсходованной на титрование контрольной пробы, мл;
Т – титр примененного для опыта раствора соляной (серной) кислоты;
m - масса исследуемого вещества, г.
При отгонке аммиака в раствор серной (соляной ) кислоты погон титруют раствором с концентрацией гидроксида натрия (реже калия) 0,1 моль/л до четкого перехода сине-фиолетового цвета в зеленый. В этом случае оттитровывают избыток раствора с концентрацией соляной кислоты 0,1 моль/л (серной - 0,05 моль/л) взятого для поглощения аммиака. Массовую долю азота в исследуемом материале рассчитывают по приведенной выше формуле с той лишь разницей, что обозначения «а», «b» и «Т» относятся не к кислоте, а к щелочи.
Умножая полученную массовую долю азота на 6,25 (фактор пересчета азота в белок), находят содержание в исследуемом материале «сырого» белка. «Сырым» белок в этом случае называют потому, что при расчете исходят не из белкового азота, а из всего азота биологического объекта (или пищевого продукта), определенного методом Кьельдаля.
Дата добавления: 2015-02-13; просмотров: 8179;
