Физико-химические свойства белков
На поверхности белковой глобулы сосредоточены в основном полярные и заряженные атомы, которые взаимодействуют с водным окружением. Именно группы основной цепи и заряженные атомы боковых цепей, а также полярные боковые цепи находятся на поверхности. Между противоположно заряженными группами образуются солевые мостики (ионные связи). Дисульфидные мостики могут быть расположены как внутри, так и на поверхности белковой глобулы. Внутренность белковой глобулы – это неполярная среда, защищенная от контакта с растворителем плотной упаковкой атомов.
Полярной или заряженной группе энергетически невыгодно находиться в таком гидрофобном окружении, если она не взаимодействует с другой гидрофобной группой или атомом с противоположным зарядом. Поэтому оставшиеся внутри амино- и карбоксигруппы основной цепи белка образуют водородные связи, формируя α-спирали и β-структуры, а заряженные группы глутаминовой кислоты и лизина образуют солевые мостики.
Сворачивание белковой молекулы осуществляется немногими путями. Информация о сворачивании белка заложена в его аминокислотной последовательности. Одно из предположений: отдельные участки белковой молекулы, например, α-спираль, формируются в первую очередь и служат как бы центрами конденсации для остальных частей молекулы. Стабильность свернутой молекулы белка в водном окружении приблизительно оценивается величиной в 40 кДж/моль.
Основной движущей силой процесса сворачивания является энтропийный гидрофобный эффект, из-за которого неполярные группы выходят из водного окружения и оказываются внутри глобулы. В дальнейшем стабилизация приводит к образованию внутренних водородных связей, а также дисульфидных и солевых мостиков, но существует и энтропийный эффект, препятствующий сворачиванию. Речь идет о том, что у свернутой молекулы число конформаций меньше, чем у развернутой. А уменьшение числа конформаций энтропийно невыгодно.
В крупных белках большая вероятность того, что молекула будет состоять из двух доменов. По своей структуре каждый домен представляет собой белок (приблизительно 40 – 300 аминокислотных остатков).
Классификация доменов:
- α/α-домены, когда белковая цепь состоит из α-спирали, а β-участок почти отсутствует; α-цепи располагаются так, что неполярные боковые цепи оказываются внутри.
- β/β-домены, когда возникает несколько β-цепей и нет или почти нет α-спиральных участков (иммуноглобулин G), β-слои частично скручены.
- α-β-домены, когда α- и β-участки чередуются вдоль цепи и β-участки формируют параллельный слой, окруженный α-спиралями.
- α+β-домены, когда α- и β-участки расположены в различных местах молекулы.
Четвертичная структура характерна для белков, построенных из нескольких пептидных цепей. Такие белки называются олигомерами, одну цепь называют протомером. Четвертичная структура – это и количество, и способ укладки протомеров в пространстве.
Протомеры связаны друг с другом посредством водородных связей, ионных и гидрофобных взаимодействий. Они взаимодействуют друг с другом определенными участками своей поверхности (контактами). Взаимное узнавание контактных участков происходит по принципу комплементарности (взаимное дополнение). Следовательно, ошибочные комплексы в олигомере практически невозможны, каждый протомер взаимодействует с другим во многих точках. Олигомерные белки способны взаимодействовать с несколькими лигандами в центрах, удаленных друг от друга. Связывание одного протомера с лигандом изменяет конформацию этого протомера и всего олигомера. При этом изменяется сродство к другим лигандам. Такие лиганды называются аллостерическими.
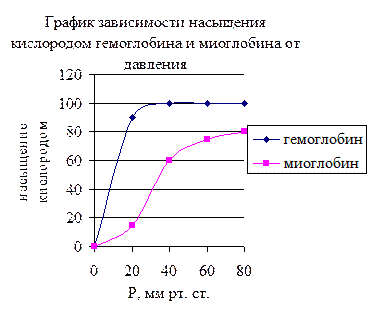
Функциональная активность олигомерных белков может регулироваться аллостерическими лигандами. Например, гемоглобин – это олигомер, состоящий из четырех промеров. Основная функция гемоглобина− связывание с кислородом в легких, где парциальное давление кислорода высокое. Он взаимодействует с четырьмя молекулами кислорода. Аллостерический эффект проявляется следующим образом: первый связанный лиганд (молекула кислорода) облегчает связывание со вторым; в свою очередь это облегчает связывание с третьим, затем с четвертым. В ткани СО2 и Н2О, которые образуются при катаболизме пищевых веществ, взаимодействуют с гемоглобином и уменьшает его сродство с кислородом, в результате регулируется содержание молекул кислорода в ткани.
В эритроцитах имеется аллостерический лиганд 2-3 дифосфоглицерат, способный взаимодействовать с дезоксигемоглобином. Следовательно, связывание гемоглобина с этим лигандом препятствует обратному связыванию освобожденного кислорода с гемоглобином. Этот эффект является результатом связывания лиганда со специфическим участком белка. Это вызывают изменение в молекуле белка, которое влияет на активность другого пространственно удаленного участка. Кооперативные изменения конформации олигомерных белков составляют основу механизма регуляции функциональной активности многих белков.
Дата добавления: 2015-02-07; просмотров: 1195;
