Начала термодинамики
Первое начало ТД для газов:
dQ=dU+PdV
dQ-количество тепла, сообщённое системе;
dU- изменение внутренней энергии;
PdV- внешняя работа, совершаемая системой.
Изменение полной энергии системы (незамкнутой ТД-системы, которая механически взаимодействует и обменивается теплотой с окружающей средой) 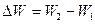 , равно полученному системой количеству теплоты
, равно полученному системой количеству теплоты 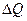 за вычетом производимой системой работы
за вычетом производимой системой работы 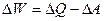 . Для системы, находящейся в состоянии равновесия при отсутствии поля внешних сил полная энергия равна внутренней (U) энергии, т.е.
. Для системы, находящейся в состоянии равновесия при отсутствии поля внешних сил полная энергия равна внутренней (U) энергии, т.е. 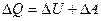 .
.
Адиабата 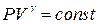 . Для адиабатического процесса
. Для адиабатического процесса 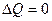 . Адиабатическим называется процесс, происходящий без теплового обмена с внешней средой. Всякий быстро протекающий процесс в газе практически адиабатен, если за время его протекания теплообмен не успевает произойти. При адиабатическом процессе внешняя работа совершается газом за счет уменьшения его внутренней энергии: dA=-dU
. Адиабатическим называется процесс, происходящий без теплового обмена с внешней средой. Всякий быстро протекающий процесс в газе практически адиабатен, если за время его протекания теплообмен не успевает произойти. При адиабатическом процессе внешняя работа совершается газом за счет уменьшения его внутренней энергии: dA=-dU
Второе начало TД: Энтропия является функцией состояния системы и для замкнутой системы при любом процессе либо возрастает, либо остаётся неизмененной, т.е. 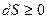 . Изменение энтропии в обратимых процессах равно нулю, а в необратимых больше нуля.
. Изменение энтропии в обратимых процессах равно нулю, а в необратимых больше нуля.
Для незамкнутых систем S может уменьшаться. Если система получает в обратимом процессе количество теплоты dQ, то изменение энтропии равно dS=dQ/T (T-температура системы).
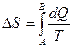
Дата добавления: 2015-02-07; просмотров: 956;
