Воспроизведение единиц концентрации
Во всем комплексе задач, связанных с обеспечением единства измерений в любой области, следует выделить две главные:
1) воспроизведение единицы;
2) передача размера единицы.
Для измерений концентрации ключевой проблемой является воспроизведение единиц этой физической величины. Одним из следствий специфики концентрации является невозможность создания эталона ни для одной из ее многочисленных единиц. Поэтому обеспечение единства измерений концентрации не может быть достигнуто в рамках централизованного воспроизведения единиц, исходным звеном которого является эталон.
Децентрализованное воспроизведение единиц концентрации. Принцип децентрализованного воспроизведения единиц концентрации представлен на рис. 148. Характерным для него является следующее:

1. Основу воспроизведения единиц концентрации составляют абсолютные методы анализа.
2. Гарантией обеспечения единства измерений является непосредственная связь с эталонами основных единиц СИ.
3. Исходными образцовыми мерами служат высокочистые вещества.
4. Исходные образцовые меры аттестуются по степени чистоты (концентрации основного компонента).
Абсолютный метод анализа — метод измерения концентрации, основанный на измерениях основных физических величин, связанных с концентрацией известной теоретической зависимостью.
Из определения абсолютного метода анализа следует, что при этом обеспечивается связь с эталонами единиц основных физических величин. Отсюда становится понятной необоснованность отнесения абсолютных методов анализа к безэталонным методам, с чем нередко приходится встречаться.
Отличие воспроизведения единиц при децентрализованном способе обеспечения единства измерений заключается прежде всего в том, что в зависимости от свойств высокочистого вещества аттестация его степени чистоты может производиться одним из абсолютных методов анализа. При этом совершенно не обязательно, чтобы она осуществлялась в одной из метрологических организаций. Ключевым звеном при реализации данного способа являются исходные высокочистые вещества, аттестованные абсолютными методами. Они служат в дальнейшем для приготовления на их основе градуировочных смесей с известной концентрацией заданного компонента, рассчитываемой по методу приготовления.
Известные локальные поверочные схемы можно рассматривать как ещё один вариант децентрализованного способа обеспечения единства измерений. Сравнивая эти оба подхода, необходимо подчеркнуть, что на самом верхнем метрологическом уровне они в равной мере основаны на применении абсолютных методов измерения для воспроизведения единиц производных величин. Отличие между ними в том, что в первом случае передача размера единицы основана на использовании образцовых мер, в то время как в локальных поверочных схемах таким образцовым средством измерений являются образцовые приборы. Преимуществом варианта с образцовыми мерами является возможность реализации самостоятельной поверки непосредственно на рабочих местах. При использовании локальных поверочных схем поверка рабочих средств измерений на стороне, как правило, сохраняется. Однако она осуществляется в основном не территориальными органами Госстандарта СССР, а ведомственной метрологической службой.
Безусловно, с позиций практики оправдано создание локальных поверочных схем для обеспечения единства измерений концентрации компонента в какой-либо продукции массового производства или при контроле окружающей среды, когда строго нормированы диапазон концентрации и состав матрицы. Однако при этом нельзя упускать из вида узкую ограниченность такой локальной схемы, В качестве примера последних отметим:
1. Комплекс газоаналитической исходной образцовой аппаратуры "Аэроника — NO2" и "Аэроника — SO2", предназначенной для воспроизведения единиц концентрации NO, NO2, SO2 в воздухе в диапазоне атмосферных загрязнений.
2. Локальную поверочную схему аттестации химических реактивов, возглавляемую кулонометрической установкой высшей точности.
Следует обратить внимание на те преимущества, которые дает децентрализованный способ обеспечения единства измерений:
1. Передача компетенции проведения точных измерений непосредственно на рабочие места. Это способствует повышению квалификации со всеми вытекающими отсюда последствиями.
2. Освобождение метрологических организаций и территориальных органов Госстандарта СССР от проведения значительного объема поверок.
3. Экономия времени и средств на проведение поверок.
4. Устранение возможности потери точностных характеристик приборов при их перевозке после поверки.
Принцип самостоятельной поверки означает, что при решении задачи обеспечения единства измерений центр тяжести переносится с точности образцовых средств, используемых при передаче размера единицы, на сам процесс.
Указанные преимущества приобретают особое значение, если принять во внимание такие тенденции развития, как:
рост числа измерительных приборов;
повышение требований к точности измерения;
создание сложных измерительных комплексов, не подлежащих транспортировке.
Однако, наряду с преимуществами, децентрализованное обеспечение единства измерений имеет один существенный недостаток — увеличение вероятности появления отклонений от установленных размеров единиц при их воспроизведении. Поэтому решающее значение приобретает обеспечение необходимой достоверности самих метрологических характеристик образцовых мер.
В метрологической практике используются три подхода к аттестации образцовых мер концентрации. По приоритету они располагаются в следующей последовательности:
1. Аттестация абсолютным методом.
2. Аттестация двумя или тремя высоконадежными независимыми, так называемыми образцовыми методами .
3. Межлабораторные сличения на основе абсолютных или образцовых методов.
Как следует из этой последовательности, предпочтение отдается абсолютным методам анализа. Это естественно, так как только на их основе в принципе может быть воспроизведена единица концентрации с установленным размером.
Недостатком абсолютных методов анализа является ограниченная область их применения, связанная как с природой и диапазоном концентрации определяемых компонентов, так и с влиянием матрицы. Кроме того, выбор абсолютных методов анализа весьма ограничен. Аттестация с применением образцовых методов и проведением межлабораторных сличений на их основе не позволяет в полной мере гарантировать отсутствие значимых отклонений от установленных размеров единиц концентрации. Если аттестация абсолютным методом невозможна, то более предпочтителен подход к передаче размера единиц концентрации, основанный на применении высокочистых веществ, для которых установлено постоянство ряда их свойств. Поэтому после краткого обзора известных абсолютных методов анализа целесообразно обсудитьроль высокочистых веществ в обеспечении единства измерений концентрации.
Абсолютные методы анализа. В разд. 6,1 было отмечено, что уравнения связи, в частности, (40) лишь в редких случаях могут быть представлены строгими зависимостями, связывающими изменения какого-либо свойства с концентрацией. Абсолютные методы анализа, как следует из их определения, как раз и представляют собой этот редкий случай. Ознакомимся с принципами абсолютных методов, обращая внимание прежде всего на физические величины, подлежащие измерениям.
Гравиметрия. Принцип гравиметрического анализа основан на законе постоянных и кратных отношений. Метод анализа заключается в определении массы продуктов реакции взаимодействия, выделяющихся при этом в виде осадка. Иногда этим методом определяют и газообразные продукты реакции после их "перевода, в осадок или поглощения. Уравнение связи прямого гравиметрического анализа для общего случая, представленного уравнением
записывается в следующем виде:

где УA — массовая доля компонента A; mA = F • тAaBb — масса компонента А в смеси; mAaBb — масса продукта реакций;
F = 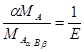 - стехиометрический фактор
- стехиометрический фактор
МA — атомная масса исследуемого компонента; МAaBb --- молярная масса продуктов реакции; тcm --- масса анализируемого вещества, содержащего компонент А .
Пример 63. Определить концентрацию углекислого кальция (СаCО3) в природном известняке, если 2,0344 г известняка при растворении его в кислоте выделяют 0,8802 г углекислого газа. Масса поглощенного щелочью углекислого газа определялась взвешиванием.
Решение. Из уравнения реакции
СаСОэ + 2НС1®СаС1, + Н, О + CO2в соответствии с уравнением (41) следует:

В гравиметрии физической величиной, связанной с концентрацией и подлежащей измерению, является масса.
Волюмометрия. Принцип газоволюмометрии основан на уравнении идеального газа. Метод объемного газового анализа заключается в определении количества газообразных продуктов реакции путем поглощения одного из компонентов газовой смеси раствором соответствующего реактива и измерении вызванного этим уменьшения объема смеси.
Уравнение связи для газоволюмометрии при постоянном давлении р и температуре Т имеет следующий вид:

MA p
где тA = ——— • VA ; МA — молярная масса компонента А ',
RT
VA — парциальный объем компонента А, соответствующий разности объемов.
Для смесей газов концентрация таким способом определяется, как правило, в молярных долях (хA = VA/V) .
Пример 64. Рассмотрим ту же задачу, что и в примере 63. Однако вместо поглощения выделившегося углекислого газа используем измерение объема этого газа. Для приведенных числовых данных объем выделившегося COi составил 499,1 см3 при температуре 25,2° С и давлении 0,99 • 10s Па.
Решение. Первым этапом является приведение измеренного объема к нормальным условиям (р = 1,01 • 10s Па; Т = 273,16 К):
p VCO2 273,15 0,99 * 105 * 499,1* 273,15
VoCO2 = --------------------------------- = -------------------------------------- =
(273,15 + t ) * 1,01 * 105 298,4 * 1,01 * 105
= 447,8 см3 .
Концентрация углекислого кальция рассчитывается по уравнению (42) с учетом того, что в соответствии с уравнением химической реакции каждому молю выделившегося СО2 отвечает моль СаСО3:
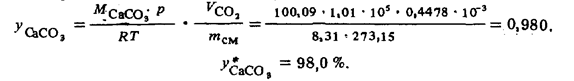
Отклонение данного результата от полученного для тех же исходных условий (см. пример 63) обусловлено отклонениями р, V, Т — зависимости для углекислого газа от закона для идеального газа.
В волюмометрии физическими величинами, связанными с концентрацией и подлежащими измерению, являются объем, давление, температура и масса.
Кулонометрия. Принцип кулонометрии основан на законе Фарадея. Метод заключается в измерении количества электричества, прошедшего через электролитическую ячейку при определенной электрохимической реакции. Уравнение связи для кулонометрического метода в предположении, что выход по току составляет 100 % и все побочные реакции отсутствуют, записывается следующим образом:
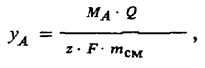
где МA — молярная масса определяемого компонента; Q = / t — количество электричества;
MAQ MA I t
mA = ——— = ———— — масса компонента А в смеси;
zF zF
z — число электронов, участвующих в электрохимической реакции; F — постоянная Фарадея.
Концентрация этим методом определяется, как правило, в массовых долях.
Кулонометрический метод анализа представляет в настоящее время один из наиболее точных методов, обеспечивающих возможность определения концентрации основного компонента до 0,99999 массовых долей.
Как следует из уравнения связи, измеряемыми физическими величинами в кулонометрическом методе анализа являются сила тока, время и масса.
Потенциометрия, ионометрия. Принцип измерений основан на возникновении на .электроде, погруженном в раствор электролита, потенциала, связанного с концентрацией электрометрически активной формы анализируемого компонента. При определенных условиях эта связь подчиняется закону Нернста. Метод прямой потенциометрии заключается либо в измерении рН (рН-метрия), либо в измерении активностей других ионов с помощью ионоселективных электродов (ионометрия). Уравнение связи для потенциометрического метода анализа в общем виде представляется выражением:
gi = f ( exp ∆E ) I = 0
Концентрация при этом выражается через массовую концентрацию.
Физической величиной, подлежащей измерению в этом методе, является разность электрических потенциалов, т. е. напряжение.
Криометрия. Принцип криометрического анализа основан на понижении температуры фазового равновесия твердое тело — жидкость под влиянием примесей, присутствующих в образце (пробе). Для идеальных растворов концентрация примесей может быть определена на основании уравнения Ван-дер-Ваальса. Метод измерения заключается в определении температуры фазового равновесия твердое тело—жидкость при плавлении или затвердевании анализируемого вещества. Уравнение связи для криометрического метода анализа высокочистых веществ в предположении отсутствия образования твердых растворов записывается следующим образом:
x2 = A ∆TH ,
где x2 -- молярная доля всех примесей, присутствующих в анализируемом образце; А — криоскопическая константа основного компонента; ∆TH — криоскопическое понижение температуры.
Концентрация данным методом определяется в молярных долях. Криометрическим методом в настоящее время возможно достоверное определение суммы всех примесей на уровне 0,00001 молярных долей.
Измеряемыми физическими величинами в данном методе являются температура и время при динамических условиях измерения температуры фазового равновесия, либо температура и количество теплоты в статических условиях измерения температуры фазового равновесия.
Спектральные методы, основанные на поглощении электромагнитного излучения. Принцип измерений основан на неупругих взаимодействиях анализируемой пробы с внешним источником электромагнитного излучения, подчиняющихся закону Ламберта-Беера. Метод заключается в измерении интенсивностей падающего 1V и прошедшего /O через поглощающий слой излучения:
IV = IO e- σv N l (43)
где σV — сечение поглощения; N — концентрация поглощающих частиц; / — длина поглощающего столба.
Концентрация в данном методе выражается числом частиц в единице объема.
Обычно спектральные методы требуют градуировки по образцовым мерам концентрации. В последнее время для анализа концентрации ряда элементов предложен подход, основанный на определении значения силы осциллятора линии, являющейся одной из основных атомных констант. Метод заключается в измерении ширины абсолютно черной линии, для которой поглощенная энергия равна энергии реального контура линии, в соответствии с уравнением
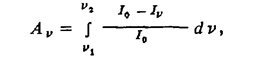
где Аv — эквивалентная ширина линии.
Для оптически тонкого слоя концентрация связана с эквивалентной шириной линии уравнением:

где p,е,т,с - константы; fnm - сила осциллятора линии, характеризующая взаимодействие излучения с веществом (вероятность перехода).
Определяя силу осциллятора линии, для чего разработан ряд способов, или располагая независимыми от градуировки данными о сечении поглощения, можно производить анализ концентрации изолированных свободных атомов в газовой фазе на основании уравнений (43) и (44), представляющих в данном случае уравнения связи абсолютного спектрального метода.
Подводя итог краткому обзору абсолютных методов анализа, следует обратить внимание, чтовыбор единицконцентрации в каждом методе обусловлен, в первую очередь,теми закономерностями, которые составляюттеоретическую основу метода. В то же время при приготовлении образцовых мер, получаемых смешиванием высокочистых веществ, концентрации компонентов смеси могут быть выражены в других единицах. При этом выбор единиц концентрации зависит от вида аналитических приборов, для градуировки которых предназначены конкретные образцовые меры.
Дата добавления: 2015-02-05; просмотров: 1653;
