Ионные уравнения
Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы, поэтому реакции и растворах электролитов фактически сводятся к реакциям между ионами.
Реакции между ионами называют ионными реакциями, а уравнения таких реакций - ионными уравнениями.
При составлении ионных уравнении следует руководствоваться тем, что формулы веществ малодиссоциирующих, нерастворимых и газообразных записываются в молекулярном виде.
Белое вещество выпадает в осадок, то рядом с его формулой ставят стрелку, направленную вниз, а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх.
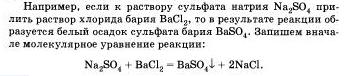
Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а уходящие из сферы реакции - в виде молекул:
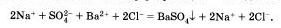
Мы записали, таким образом, полное ионное уравнение реакции.
Если исключить из обеих частей равенства одинаковые ионы, то есть не участвующие в реакции в левой и правой часто уравнения), то получим сокращенное ионное уравнение реакции:
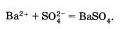
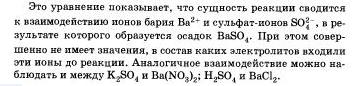
Таким образом, сокращенные ионные уравнения представляют собой уравнения в общем виде, которые характеризуют сущность химической реакции показывают, какие ионы реагируют и какое вещество образуется в результате.
Реакции ионного обмена протекают до конца в тех случаях, когда образуется или осадок, или малодиссоциирующее вещество, например вода. Беля к раствору гидроксида натрия, окрашенного фенолфталеином в малиновый цвет, прилить избыток раствора азотной кислоты, то раствор обесцветится, что послужит сигналом протекания химической реакции:
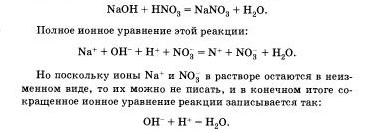
Оно показывает, что взаимодействие сильной кислоты и щелочи сводится к взаимодействию ионов Н+ и ионов ОН -, в результате которого образуется малодиссоцвирующее вещество — вода.
Указанная реакция взаимодействия сильной кислоты со щелочью называется реакцией нейтрализации. Это частный случай реакции обмена.
Подобная реакция обмена может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями. Например, если получить голубой осадок нерастворимого гидроксида меди (II) взаимодействием сульфата меди II со щелочью:
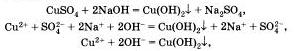
а затем поделить полученный осадок на три части и прилить к осадку в первой пробирке раствор серной кислоты, к осадку во второй пробирке раствор соляной кислоты, а к осадку в третьей пробирке раствор азотной кислоты, то во всех трех пробирках осадок растворится. Это будет означать, что во всех случаях прошла химическая реакция, суть которой и отражена с помощью одного и того же ионного уравнения.
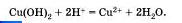
Чтобы в этом убедиться, запишите молекулярные, полные и сокращенные ионные уравнения приведенных реакций.
Рассмотрим ионные реакции, которые протекают с образованием газа. В две пробирки нальем по 2 мл растворов карбоната натрия и карбоната калия. Затем в первую прильем раствор соляной, а во вторую — азотной кислоты. В обоих случаях мы заметим характерное "вскипание" из-за выделяющегося углекислого газа. Запишем уравнения реакций для первого случая:
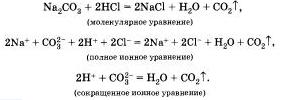
Реакции, протекающие в растворах электролитов, эапис каются с помощью ионных уравнений. Эти реакции называл реакциями ионного обмена, так как в растворах электролиты обмениваются своими ионами. Таким образом, можно сделать два вывода.
1. Реакции в водных растворах электролитов являются реакциями между ионами, а потому изображаются в виде ионных уравнений.
Они проще молекулярных и носят более общий характер.
2. Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество.
7. Комплексные соединения
Дата добавления: 2015-01-10; просмотров: 2573;
