Некоторые щелочи.
Гидроксид натрия NaОН — твердое белое вещество, гигроскопичное и поэтому расплывающееся на воздухе; хорошо растворяется в воде, при этом выделяется теплота. Раствор гидроксида натрия в воде мылкий на ощупь и очень едкий. Он разъедает кожу, ткани, бумагу и другие материалы. За это свойство гидроксид натрия получил название едкого натра. С гидроксидом натрия и его растворами надо обращаться осторожно, опасаясь, чтобы они не попали на одежду, обувь, а тем более на руки и лицо. На коже от этого вещества образуются долго не заживающие раны. NaОН применяют в мыловарении, кожевенной и фармацевтической промышленности.
Гидроксид калия КОН — тоже твердое белое вещество, хорошо растворимое в воде, с выделением большого количества теплоты. Раствор гидроксида калия, как и раствор едкого натра, мылок на ощупь и очень едок. Поэтому гидроксид калия иначе называют едкое кали. Применяют его в качестве добавки при производстве мыла, тугоплавкого стекла.
Гидроксид кальция Са(ОН)2 или гашеная известь, — рыхлый белый порошок, немного растворимый в воде (в таблице растворимости против формулы Са(ОН)а стоит буква М, что означает малорастворпмое вещество). Получается при взаимодействии негашеной извести СаО с водой. Этот процесс называют гашением. Гидроксид кальция применяют в строительстве при кладке и штукатурке стен, для побелки деревьев, для получения хлорной извести, которая является дезинфицирующим средством. Прозрачный раствор гидроксида кальция называется известковой водой. При пропускании через известковую воду СО2 она мутнеет. Такой опыт служит для распознавания углекислого газа. Реакции, с помощью которых распознают определенные химические вещества, называют качественными реакциями.
Для щелочей тоже существуют качественные реакции, с помощью которых растворы щелочей можно распознать среди растворов других веществ. Это реакции щелочей с особыми веществами — индикаторами (лат. «указателями»). Если к раствору щелочи добавить несколько капель раствора индикатора, то он изменит свой цвет (табл. 4).
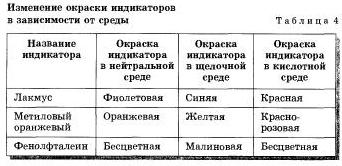
В таблице 4 приведены индикаторы и указано изменение их окраски в щелочной среде, а также в кислотной среде.
1. Основания – это сложные вещества, состоящие из ионов металлов и гидроксид-ионов. Примеры формул оснований: KOH, Mg(OH)2.
2. Основания бывают однокислотные и многокислотные. Однокислотные – основания, в формулах которых указан один гидроксид-ион: KOH, NaOH. Многокислотные – основания, в формулах которых два и более гидроксид-ионов: Ca(OH)2. 3. Все основания – твердые вещества. Поэтому их разделяют не по агрегатному состоянию, а по растворимости в воде. По этому признаку основания подразделяют на две группы - растворимые и нерастворимые основания. 4. Растворимые (их называют щелочами). Такие основания образуют металлы главной подгруппы I группы – Li, Na, K, Rb, Cs, Fr (эти металлы называют щелочными), а также некоторые металлы главной подгруппы II группы - Ca, Sr, Ba (эти металлы называют щелочно-земельными).Все основания, кроме раствора аммиака в воде, представляют собой твердые вещества, имеющие различную окраску. Например, гидроксид кальция Са(ОН)2 белого цвета, гидроксид меди (II) Сu(ОН)2 голубого цвета, гидроксид никеля (II) Ni(OH)2 зеленого цвета, гидроксид железа (III) Fе(ОН)3 красно-бурого цвета и т. д.Водный раствор аммиака NH3 * H2O в отличие от других оснований содержит не катионы металла, а сложный однозарядный катион аммония NH4 и существует только в растворе (этот раствор вам известен под названием нашатырного спирта). Он легко разлагается на аммиак и воду: 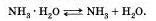
Разделение оснований на группы по различным признакам представлено в таблице 11.
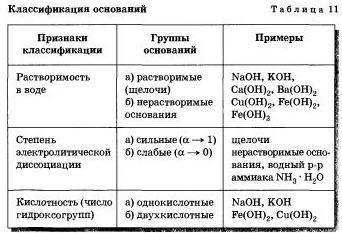
Все основания, и в первую очередь щелочи (сильные электролиты), образуют при диссоциации гидроксид-ионы ОН-, которые и обусловливают ряд общих свойств: мылкость на ощупь, изменение окраски индикаторов (лакмуса, метилового оранжевого и фенолфталеина), взаимодействие с другими веществами.
Дата добавления: 2015-01-10; просмотров: 2804;
