Строение и свойства атомов.
1. Установите деталь на плите. Плоскую деталь необходимо зафиксировать с помощью пластилина, цилиндрическую – поместить в призму.
2. Включите прибор тумблером 2 рис.4.11 (положение «сеть»). После включения должна загореться сигнальная лампа 4.
3. Опустите датчик рукояткой 4 рис.4.10 на измеряемую поверхность детали до тех пор, пока не совпадут треугольные знаки на штоке и планке 10. Застопорите рукоятками положение датчика.
4. На переключателе пределов измерений нажмите кнопку предполагаемого значения шероховатости измеряемой поверхности.
5. Установите рычажком 9 рис.4.10 на приводе требуемую отсечку шага. При этом следует учитывать, что перемещение датчика будет равно:
- при отсечке шага 0,25 мм – 2 мм (1,5 мм трасса интегрирования + 0,5 мм предварительный ход);
- при отсечке шага 0,8 мм – 6,4 мм (4,8 мм трасса интегрирования + 1,6 мм предварительный ход).
6. Нажмите кнопку «пуск» на электронном блоке. При нажатии кнопки загорится сигнальная лампа 6, которая свидетельствует о движении датчика. После остановки датчика (сигнальная лампа погаснет) произведите отсчет параметра Ra по шкале показывающего прибора.

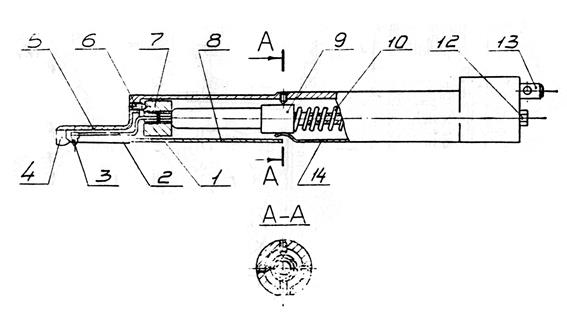
Рис. 4.8. Датчик профилометра (тип А модель 283)
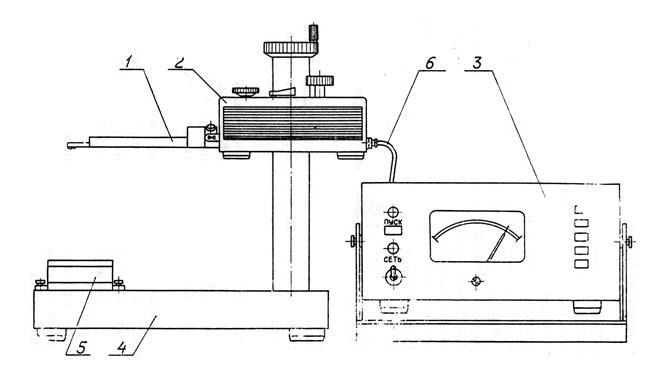
Рис. 4.9. Общий вид профилометра (тип А модель 283)
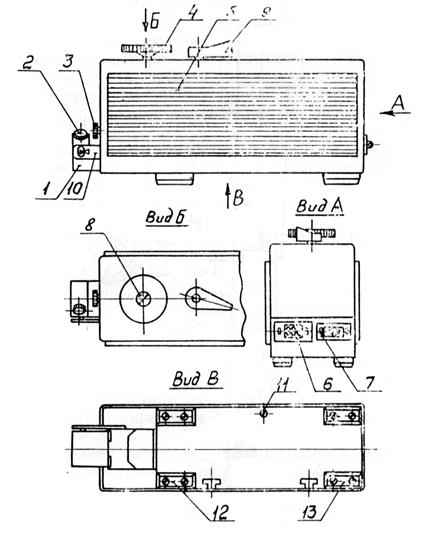
Рис. 4.10. Привод профилометра (тип А модель 283)
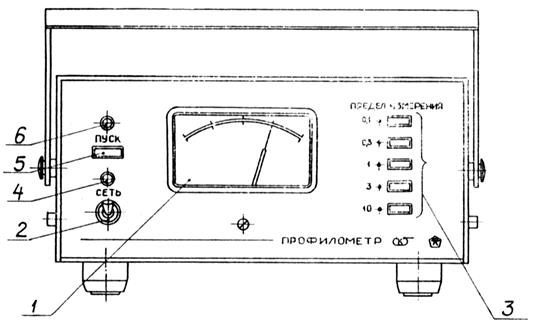
Рис. 4.11. Электронный блок профилометра (тип А модель 283)
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ ПРИ ПОДГОТОВКЕ
К ЛАБОРАТОРНОЙ РАБОТЕ
«МЕТОДЫ И СРЕДСТВА КОНТРОЛЯ ШЕРОХОВАТОСТИ ПОВЕРХНОСТИ»
1. Что такое шероховатость поверхности и чем она отличается от чистоты?
2. Назовите все шесть параметров шероховатости поверхности, установленных ГОСТ 2789-73.
3. Дайте характеристику каждому из параметров шероховатости.
4. Единицы измерения параметров шероховатости поверхности.
5. Расскажите, что из себя представляют и как используются образцы шероховатости.
6. Какие из параметров шероховатости могут быть измерены при помощи двойного микроскопа Линника и профиломера?
7. Пределы измерения параметров шероховатости с помощью указанных приборов.
8. Методика измерения шероховатости с помощью двойного микроскопа МИС-11.
9. Укажите метод измерения шероховатости на приборах МИС-11 и профилометре.
Примечание. С января 2005 года изменяется метод обозначения шероховатости на чертежах, например:
заменяется
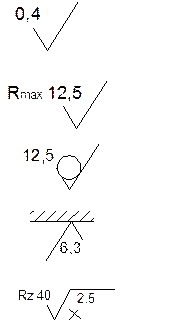 |
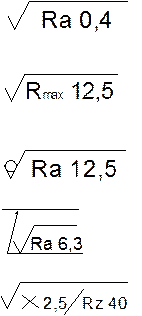 на
на
на
на
на
на
Таблица перевода шероховатости из классов в мм
| Обозначение классов чистоты поверхности по ГОСТ 2789-59 | Ñ1 | Ñ2 | Ñ3 | Ñ4 | Ñ5 | Ñ6 | Ñ7 | Ñ8 | Ñ9 | Ñ10 | Ñ11 | Ñ12 | Ñ13 | Ñ14 | |||||
| Обозначение шероховатости поверхности по ГОСТ 2789-73 | Rz = Rmax, мкм | 2,5 | 1,25 | 0,63 | 0,32 | 0,16 | 0,1 | 0,05 | |||||||||||
| Ra наибольшее значение, мкм | 2,5 | 1,25 | 0,63 | 0,32 | 0,16 | 0,08 | 0,04 | 0,02 | 0,01 | ||||||||||
| Ra наименьшее значение, мкм | 12,5 | 6,3 | 3,2 | 1,6 | 0,8 | 0,4 | 0,2 | 0,1 | 0,05 | 0,02 | |||||||||
| Базовая длина L, мм | 8,0 | 2,5 | 0,8 | 0,25 | 0,08 | ||||||||||||||
Строение и свойства атомов.
Железо Fе — элемент побочной подгруппы VIII группы и 4-го периода Периодической системы Д. И.Менделеева.
Атомы Ре устроены несколько отлично от атомов элементов главных подгрупп. Как и положено элементу 4-го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра, уровень. На последнем же уровне атомы железа содержат два электрона. На предпоследнем уровне, который может вместить 18 электронов, у атома железа находятся 14 электронов. Следовательно, распределение электронов по уровням в атомах железа таково: 2е-; 8е- ; 14е- ; 2е-.
Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления +2, но и электрон с предпоследнего уровня, при этом степень окисления атома повышается до +3.
Железо — простое вещество. Это серебристо-белый блестящий металл с температурой плавления 1539 °С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.Различают технически чистое и химически чистое железо.
Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02—0,04% углерода, а кислорода, серы, азота и фосфора — еще меньше.
Химически чистое железо содержит менее 0,01% примесей. Из технически чистого железа сделаны, например, канцелярские скрепки и кнопки. Такое железо легко корродирует, в то время как химически чистое железо почти не подвергается коррозии.
Первые образцы железа, попавшего в руки человека, очевидно, были метеоритного происхождения. О знакомстве человека в древности с железом космического происхождения говорит факт наличия у жителей Гренландии, не имевших никакого понятия о железной руде, изделий из железа. Алхимики обозначали железо в виде копья и щита — характерных атрибутов бога войны Марса.
В настоящее время железо — это основа современной техники и сельскохозяйственного машиностроения, транспорта и средств связи, космических кораблей и вообще всей современной цивилизации. Большинство изделий, начиная от швейной иглы и кончая космическими аппаратами, не может быть изготовлено без применения железа.
Переходя к описанию химических свойств железа, повторим, что оно может проявлять степени окисления +2 и +3, соответственно железо дает два ряда соединений. Число электронов, которое атом железа отдает при химических взаимодействиях, зависит от окислительной способности реагирующих с ним веществ. Например, с галогенами железо образует галоге-ниды, в которых оно имеет степень окисления +3:

В соответствии с положением железа в электрохимическом ряду напряжений оно может вытеснять металлы, стоящие правее него, из водных растворов их солей.
В разбавленных соляной и серной кислотах железо растворяется, т. е. окисляется ионами водорода.
Растворяется железо и в разбавленной азотной кислоте, при этом образуются нитрат железа(III), вода и продукт восстановления азотной кислоты — N2, N0 или NH2(NН4NO3) в зависимости от концентрации кислоты.
Соединения железа.
По распространенности в земной коре железо занимает четвертое место среди всех элементов (после кислорода, кремния и алюминия).
В природе железо образует ряд минералов. Это магнитный железняк (магнетит) Fе3O4, красный железняк (гематит) Fе203, бурый железняк (лимонит) 2Fе2O3 * ЗН20.
Все они используются в черной металлургии для производства чугуна и стали. Еще одно природное соединение железа — железный, или серный, колчедан (пирит) FеS2, не служит железной рудой для получения металла, но применяется для производства серной кислоты.
Как уже было сказано выше, для железа характерны два ряда соединений: соединения железа(II) и железа(III).
Оксид железа(II) FеО и соответствующий ему гидроксид железа(II) Fе(ОН)2 получают косвенно, в частности по следующей цепи превращений:
Fе -> FеС12 -> Fе(ОН)2 -> FеО
Оба соединения имеют ярко выраженные основные свойства.
Катионы железа(II) Fе2+ легко окисляются кислородом воздуха или другими окислителями до катионов железа(III) Fе3+. Поэтому белый осадок гидроксида железа(II) Fе(ОН)2 на воздухе сначала приобретает зеленую окраску, а затем становится бурым, превращаясь в гидроксид железа(III):
4Fе(0Н)2 + 2Н20 + 02 = 4Fе(0Н)3
Оксид железа(ІІІ) Fе2O3 и соответствующий ему гидроксид железа(ІІІ) Fе(ОН)3 также получают косвенно.
Из солей железа наибольшее техническое значение имеют сульфаты и хлориды.
Кристаллогидрат сульфата железа FеSО • 7Н20, известный под названием железный купорос, применяют для борьбы с вредителями растений, для приготовления минеральных красок и в других целях.
Хлорид железа(ІІІ) FеСl3 используют в качестве протравы при крашении тканей.
Сульфат железа(ІІІ) Fе2(SO4)3 • 9Н20 применяется при очистке воды и в других целях.
Для распознавания соединений железа(II) и (IIІ) проводят качественные реакции на ионы Fе2+ и Fе3+. Качественной реакцией на ионы Fе2+ служит реакция солей железа с соединением, называемым красной кровяной солью. Соединения такого типа вам еще не знакомы. Это особая группа солей, которые называются комплексным и1. С ними вы будете знакомиться в старших классах. Пока же вам нужно усвоить, как диссоциируют такие соли:
К3[Fе(СN6)] = ЗК+ + [Fе(СN)6] 3-
Реактивом на ионы Fе3+ является другое комплексное соединение — желтая кровяная соль — К4[Fе(СN)6], которая в растворе диссоциирует аналогично.
Если к растворам, содержащим ионы Fе2+ или Fе3+, прилить, соответственно, растворы красной кровяной соли (реактив на Fе2+) и желтой кровяной соли (реактив на Fе3+), то в обоих случаях выпадает одинаковый синий осадок. Для обнаружения ионов Fе3+ еще используют взаимодействие солей железа(III) с роданидом калия КNCS или аммония NH4NCS. При этом образуется ярко окрашенный ион FеNCS 2+, в результате чего весь раствор приобретает интенсивно-красный цвет.
Роль железа в жизнедеятельности живых организмов очень велика.
Оно входит в состав гемоглобина крови, который осуществляет перенос кислорода от органов дыхания к другим органам и биологическим тканям.
Окраску крови придают именно соединения железа. Если лишить железа растения и животных, то они изменяют свою окраску. Как человек бледнеет, когда не хватает гемоглобина в крови, так и растение, растущее при недостатке железа в почве, будет бледным или даже бесцветным. Поэтому соединения железа издавна применяются для лечения малокровия, при истощении, упадке сил.
Для человека и животных источником железа служат растения. В зеленых овощах, таких, как шпинат, салат, капуста, железа много. Чем интенсивнее окрашены растения и животные, тем больше в них железа. Так, розовая вишня содержит наполовину меньше железа, чем черная. Светло-зеленый капустный лист в шесть раз беднее железом, чем зеленый. В говядине железа больше, чем в телятине.
4. Соли, основания
Соли — зто сложные вещества, состоящие из ионов металлов и кислотных остатков.
Номенклатура солей приведена в таблице 5.
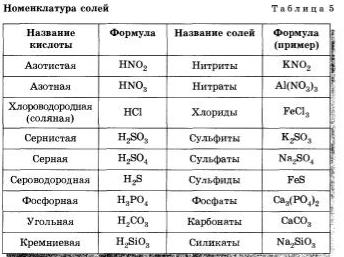
По растворимости в воде соли делятся на растворимые нерастворимые (Н) и малорастворнмые (М). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если под рукой нет згой таблицы, можно воспользоваться приведенными ниже правилами. Их легко запомните.
1. Растворимы все соли азотной кислоты — нитраты.
2. Рвстворимы все соли соляной кислоты — хлориды, кроме AgCI(H). РbСl2,(М).
3. Растворимы все соли серной кислоты сульфаты, кроме BaSO4(H). PbSO4(H).
4. Растворимы соли натрия и калия.
5. Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме этих солей для Na+ и К+.
Рассмотрим растворимую натриевую соль бескислородной соляной кислоты — хлорид натрия NaCI, и нерастворимые кальциевые соли угольной и фосфорной кислот - карбонат кальция и фосфат кальция.
Хлорид натрия NaCI — хорошо растворимая н воде соль, известна под названием поваренная соль. Без втой соли невозможна жизнь растений, животных и человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создает необходимые условия для существования красных кровяных телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможным переваривание и усвоение пищн. Необходимость соли для жизни была известна со времен глубочайшей древности. Значение соли отражено в многочисленных пословицах, поговорках, обычаях. Хлеб да соль — вот одно из пожеланий, которым русские люди с давних пор обменивались друг с другом во время приема пищи, подчеркивая равноценное с хлебом значение соли. Хлеб и соль стали символом гостеприимства и радушия русской нации.
Хлорид натрия широко используют в химической промышленности для получения натрия, хлора, соляной кислоты, в медицине, для приготовления пищи, для консервирования продуктов питания (соление и квашение овощей) и т. д.
Карбонат кальция СаСО3, нерастворимый в воде, — важнейшая соль, из которой многочисленные морские животные (моллюски, раки, простейшие) строят покровы своего тела — разнообразные по форме, многоцветные по окраске раковины. Скапливаясь после гибели своих хозяев на дне водоемов и главным образом морей, эти раковины за десятки и сотни миллионов лет образовали мощные пласты соединений кальция, давших начало образованию горных пород — известняков СаСО3. Эту же формулу имеет и замечательный строительный камень — мрамор, и столь привычный каждому школьнику, стоящему у доски, мел. Из известняка получают негашеную и гашеную известь, строят дома. Мрамор идет на изготовление статуй, мрамором отделаны станции московского метро.
Из этой соли наземные животные «строят» свои скелеты — внутреннюю опору для мягких тканей, которые в десятки раз превышают вес самой опоры.
Фосфат кальция Са(РО4)2 нерастворим в воде — это основа минералов фосфоритов и апатитов. Из них производят необходимые в сельском хозяйстве фосфорные удобрения, без которых, в свою очередь, было бы невозможно получение высоких урожаев. Он входит в состав костей животных.
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
В начале XIX в. шведский химик И. Верцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
Na2С03 — карбонат натрия, СuSO4 — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
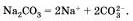
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят, например, питьевую соду, которая состоит из катиона металла и кислотного однозарядного остатка НСО3. Для кислой кальциевой соли формула записывается так: Са(НСО3)2.
Названия этих солей складываются из названий солей с прибавлением слова гидро, например:
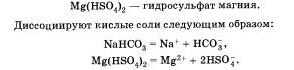
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например, к таким солям относится знаменитый малахит (СиОН)2 С03, о котором вы читали в сказах И. Бажова. Он состоит нз двух основных катионов СиОН и двухзарядного аниона кислотного остатка СО 2- 3.
Катион СuОН+ имеет заряд +1, поэтому в молекуле два таких катиона и один двухзарядный анион СО объединены в электронейтральную соль.
Названия таких солей будут такими же, как и у нормальных солей, но с прибавлением слова гидроксо-, например (СuОН)2 СО3 — гидроксокарбонат меди (II) или АlOНСl2 — гидроксохлорид алюминия. Подавляющее большинство основных солей нерастворимы или малорастворимы. Последние диссоциируют так:
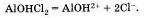
Типичные реакции солей

4. Coль + металл —> другая соль + другой металл.
Первые две реакции обмена уже были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием оселка, например:
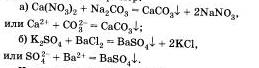
Четвертая реакция солей связана с именем крупнейшего русского химика Н.Н.Бекетова, который в 1865 г. изучал способность металлов вытеснять из растворов солей другие металлы. Например, медь tu растворов ее солей можно вытеснять такими металлами, как магний, алюминий Al, цинк и другими металлами. А вот ртутью, серебром Аg, золотом Аu медь не вытесняется, так как атм металлы в ряду напряжений расположены правее, чем медь. Зато медь вытесняет их из растворов солей:
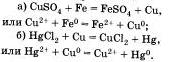
H. Бекетов, действуя газообразным водородом под давлением на растворы солей ртути и серебра, установил, что при атом водород, так же как и некоторые другие металлы, вытесняет ртуть и серебро из их солей.
Располагая металлы, я также водород по их способности вытеснять друг друга ял растворов солей. Бекетов составил ряд. который он назвал вытеенительным рядом металлов. Позднее (1802 г. В. Нерист) было доказано, что вытесни тельный ряд Векетовп практически совпадает с рядом, в котором металлы и водород расположены (направо) в порядке уменьшения их восствнояятеяьяой способности и молярной концентрации ионов металла, равна 1 моль/л. Этот ряд называют алектрохимычесиим рядам напряжений металлов. Вы уже знакомились с этим рядом, когда рассматривали взаимодействие кислот с металлами и выяснили, что с растворами кислот взаимодействуют металлы, которые расположены левее водорода. Это первое при вило ряда напряжений Оно выполняется с соблюдением ряда условий, о которых мы говорили ранее.
Второе правило ряда напряжений заключается в следующем: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений.
Это правило также соблюдается при выполнении условий:
а) обе соли (и реагирующая, и образующяяся в результате реакции) должны быть растворимыми;
б) металлы ие должны аза имодействовать с водой, поэтому металлы главных подгрупп I и II групп (для последней начиная с Са) ие вытесняют другие металлы на растворов солей.
1. Соли средние (нормальные), кислые и основные.
2. Диссоциация различных груп солей.
3. Типичные свойства нормальных солей: взаимодействие их с кислотами, щелочами, другими солями и металлами.
4. Два правила ряда напряжений металлов.
5. Условия протекания реакций солей с металлами.
Дата добавления: 2015-01-10; просмотров: 2613;
