Молекулы иммунной системы
Для осуществления необходимых функций клетки иммунной системы имеют сложную молекулярную организацию своих рецепторов и способны к выработке целого ряда молекул.
1. Антигенпредставляющие, антигенраспознающие и антигенсвязывающие молекулы.Набор этих молекул уникален для каждого организма, для каждого лимфоцитарного клона и для каждого специфического иммунного ответа. К ним относятся:
• свободные иммуноглобулины: IgM, IgG, IgA, IgE, IgD;
• антигенпредставляющие молекулы: лейкоцитарные антигены главного комплекса гистосовместимости (human leukocyte antigens - HLA I и II) и молекулы CD1 (a, b, c, d, e);
• иммуноглобулиновые рецепторы В-клеток для распознавания и связывания антигена (B cellular receptors - BCR);
• рецепторы Т-клеток для распознавания и связывания антигена (T cellular receptors - TCR);
2. Адгезивные молекулыопосредуют взаимодействия между клетками и лигандами при непосредственном контакте:
• суперсемейство иммуноглобулиноподобных молекул;
• интегрины;
• селектины;
• муцины;
• суперсемейство рецепторов к факторам некроза опухоли и фактору роста нервов - TNF/NGF (или молекулы, опосредующие апоптоз);
• линк-семейство (компоненты экстрацеллюлярного матрикса).
3. Иммуноцитокиныявляются гормонами иммунной системы, действующими чаще с пара- и аутокринным, реже - с эндокринным эффектами:
• интерлейкины (interleukins - ILs);
• колониестимулирующие факторы (colony-stimulating factors -
CSFs);
• интерфероны (interferons - IFNs);
• факторы некроза опухоли (tumor necrosis factors - TNFs);
• трансформирующие факторы роста (transforming grows factors -
TGFs);
• хемокины и др.
4. Сборная группа различных медиаторов воспалениявключает белки комплемента, белки острой фазы, простаноиды и лейкотриены, протеолитические ферменты и др.
Иммуноглобулины(immunoglobulin - Ig) M, G, A, E и Dявляются эффекторными молекулами гуморального иммунного ответа. Молекула иммуноглобулина является гликопротеином; белковые цепи включают сотни aминокислотных последовательностей; углеводный компонент составляет до 12%. Молекула IgG (рис. 7-1) состоит из двух идентичных легких (light - L) и двух идентичных тяжелых (heavy - H) цепей (chains). Легкие цепи бывают двух типов: χ и λ, а тяжелые - пяти: μ, γ, α, ε и δ. Легкие и тяжелые цепи содержат повторяющиеся гомологичные последовательности и об-
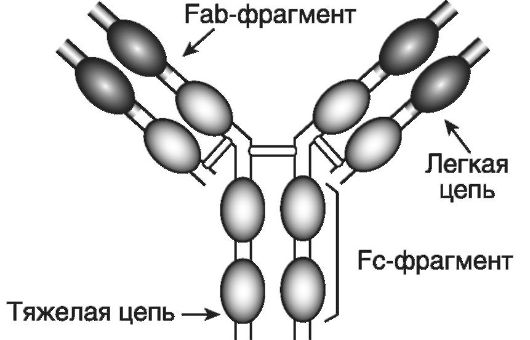 Рис. 7-1.Структура молекулы IgG. Молекула IgG состоит из двух идентичных легких и двух идентичных тяжелых цепей, которые образуют три фрагмента: два Fab (антисвязывающие сайты) и один Fc (неспецифические эффекторные функции). Цепи укладываются таким образом, что возникают «клубки» - домены, которые могут быть вариабельными или константными
Рис. 7-1.Структура молекулы IgG. Молекула IgG состоит из двух идентичных легких и двух идентичных тяжелых цепей, которые образуют три фрагмента: два Fab (антисвязывающие сайты) и один Fc (неспецифические эффекторные функции). Цепи укладываются таким образом, что возникают «клубки» - домены, которые могут быть вариабельными или константными
разуют своеобразные домены (клубки или глобулы). Существуют константные (constant) (CL, CH1, CH2 и CH3) и вариабельные (variable) домены (VL и VH). Гипервариабельные области вариабельных доменов формируют антигенсвязывающие сайты (активные центры). Участок CL-CH1 определяет различия амонокислотных последовательностей у индивидуумов одного и того же вида. Антигенсвязыгаающие сайты и область CL-CH1 входят в состав так называемых Fab (fragment antigen-binding)-фрагментов (их 2), ответственных за связывание антигена, а участки CH2-CH2 и СН3- СН3 формируют Fc (fragment crystalline)-фрагмент, отвечающий за неспецифические эффекторные функции. Например, область CH2-CH2 участвует в фиксации и активации компонентов комплемента, а область СН3-СН3 - в фиксации антител к клеткам. Между Fab- и Fc-фрагментами тяжелых цепей имеется шарнирная область, обеспечивающая гибкость молекулы антитела.
IgMявляются эволюционно наиболее древними антителами и составляют 5-10% всех иммуноглобулинов. Они являются также первыми антителами новорожденных, не проникают через плаценту. вырабатываются только при первичном иммунном ответе. Они появляются в крови в начале иммунного ответа и затем замещаются IgG. служат основными рецепторами для распознавания антигенов на поверхности зрелых В-лимфоцитов. В
сыворотке крови существуют в виде пентамеров (т.е. имеют 5 мономерных субъединиц). связывают комплемент и активируют его по классическому пути.
На IgGв сыворотке крови человека приходится около 75% от общего числа иммуноглобулинов. Вырабатываются они как при первичном, так и при вторичном иммунном ответе вслед за IgM. IgG способны проникать в ткани, через плаценту, связывать комплемент и активировать его по альтернативному пути. Каждая молекула IgG состоит из 2 легких и 2 тяжелых цепей. У человека имеется 4 подкласса IgG, различающихся последовательностью аминокислот в тяжелой цепи.
IgAсоставляют 7-15% общего количества сывороточных иммуноглобулинов. IgA содержатся в секретах (слюне, слезной жидкости, секретах желудочно-кишечного и мочеполового тракта, слизистой носа и грудной желез), где они находятся в виде секреторного IgA - sIgA - димера, состоящего из 2-х соединенных между собой молекул IgA и гликопротеина, называемого секреторным компонентом (СК). СК образуется в эпителиальных клетках и предохраняет молекулу IgA от расщепления. выходят из кровотока и проникают через эпителиальный слой, соединяясь с СК. Образовавшийся sIgA отщепляется от поверхности эпителиальной клетки и поступает в секреты, где реализует свою защитную функцию - предотвращает проникновение антигена с внешних поверхностей в ткани.
Содержание IgEв сыворотке крови является наиболее низким - около 0,003%. Они накапливаются главным образом в слизистых оболочках и коже, где за счет своего Fс-фрагмента фиксируются на поверхности тучных клеток, базофилов и эозинофилов. При связывании антигена с IgE происходит дегрануляция этих клеток и выброс в кровь биологически активных веществ. Защитная роль IgE до сих пор не выяснена, однако установлено повышение сывороточной концентрации иммуноглобулинов данного типа при инфекциях и аллергических состояниях.
IgDтакже содержатся в сыворотке в небольших количествах. IgD экспрессируются на поверхностной мембране В-лимфоцитов, формируя вместе с антигенраспознающий В-клеточный рецептор (BCR).
Химическая природа антител была подробно изучена нобелевскими лауреатами (1972) G.M. Edelman (США) и R.R. Porter (Великобритания).
Каждый В-лимфоцит экспрессирует В-клеточный антигенраспознающий рецептор(BCR), который состоит из мономерных IgM и IgD, имеет клональную гетерогенность и ассоциирован с молекулами CD79a и CD79b, необходимыми для проведения сигнала внутрь клетки. Наряду с этими молекулами имеется также корецепторный комплекс (CD19, CD21(CR2), CD81), предназначенный для распознавания HLA II.
Каждый Т-лимфоцит экспрессирует Т-клеточный антигенраспознающий рецептор abTCR), который состоит из двух цепей - a и β, и имеет один из корецепторов - CD4 (у Т-хелперов) или CD8 (у цитотоксических Т-лимфоцитов). Эти инвариантные корецепторы CD4 и CD8 необходимы для распознавания соответственно HLA II или HLA I. Каждая цепь TCR подобно молекуле иммуноглобулина имеет вариабельный и константный домены, что обеспечивает клональную гетерогенность антигенраспознающих рецепторов. Еще одна молекула (CD3) тесно ассоциирована c TCR и служит для проведения сигнала внутрь клетки. CD3 состоит из 5 инвариантных белков (ε, γ, δ, ξ, η). Другой тип антигенраспознающего рецептора - γδTCR - экспрессируется на небольшой субпопуляции Т-клеток. Эти γδT-клетки, роль которых пока до конца не исследована, по-видимому, функционируют подобно NK-клеткам, однако они также имеют определенную клональную гетерогенность.
Синтез и экспрессия на мембране лимфоцитов TCR и ВCR происходят во время лимфопоэза, т.е. при отсутствии антигена. Каждый лимфоцит экспрессирует только один вариант антигенсвязывающего рецептора, т.е. каждый лимфоцит предназначен для распознавания и связывания только одного конкретного антигена.
Молекулы гистосовместимостибыли открыты нобелевскими лауреатами (1980) В. Benacerraf (США), J. Dausset (Франция) и G.D. Snell (США). Эти молекулы играют решающую роль во многих иммунных процессах, включая загрузку антигенных пептидов и их презентацию. Молекулы HLA разделяются на класс I (A, B, C, E, F, G) и класс II (DR, DP, DQ) в зависимости от их структуры и функции. Экспрессия HLA I имеет место почти на всех клетках (за исключением синцитиотрофобласта), выполняя функцию взаимной информации клеток внутри организма об аутологичности; экспрессия HLA II обнаруживается исключительно на клетках иммунной системы: B-лимфоцитах, макрофагах, эндотелиоцитах, активированных Т-клетках и др.
Молекула HLA I (рис. 7-2) состоит из трехдоменной α-цепи и β2-микроглобулина, связь между которыми стабилизируется калнексином. Между доменами α1 и α2 имеется желобок, предназначенный для загрузки антигена. После того как антиген загружается, происходит высвобождение β2-микроглобулина, возможно, за счет конформационных изменений. Имеется около 180 генов с более чем 500 аллелями (на хромосоме 6), кодирующих синтез молекул HLA I, что обеспечивает их видоспецифический и индивидуальный полиморфизм. Молекула HLA II состоит из двух димеров - α и β. Вариабельные домены α1 и β1 формируют желобок для загрузки антигена. В целом β-цепи HLA-DR, DP, DQ характеризуются меньшей гетерогенностью; известно более 300 аллельных продуктов HLA II (более 20 генов, кодирующих HLA II, также находятся на хромосоме 6). Для контроля укладки при синтезе, протекции, транспорте и загрузке антигенных пептидов на HLA служат особые молекулы - шапероны(калнексин, кальретикулин, инвариантная цепь Ii и др).
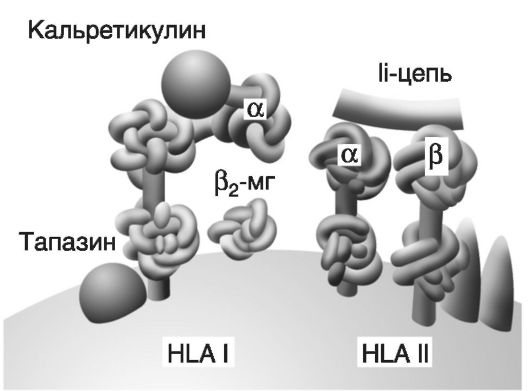 Рис. 7-2.Структура белков гистосовместимости (HLA I и HLA II) и шапероны. Молекула HLA I состоит из α-цепи (три домена) и β2-микроглобулина ф2-МГ). Молекула HLA II содержит две цепи: α (два домена) и β (тоже два домена). Шапероны (кальретикулин, тапазин, Ii-цепь и др.) - это белки, ответственные за правильную укладку белковых молекул; в частности, шапероны обеспечивают протекцию «желобков» молекул HLA до момента загрузки на них антигенных пептидов
Рис. 7-2.Структура белков гистосовместимости (HLA I и HLA II) и шапероны. Молекула HLA I состоит из α-цепи (три домена) и β2-микроглобулина ф2-МГ). Молекула HLA II содержит две цепи: α (два домена) и β (тоже два домена). Шапероны (кальретикулин, тапазин, Ii-цепь и др.) - это белки, ответственные за правильную укладку белковых молекул; в частности, шапероны обеспечивают протекцию «желобков» молекул HLA до момента загрузки на них антигенных пептидов
Не-HLA молекулы CD1 (a, b, c, d, e),которые состоят по аналогии с HLA I из α-цепи и β2-микроглобулина, также вовлечены в процессы загрузки антигенов, но небелковой природы (фосфолипиды, липополисахариды).
Имеется связь между наследованием некоторых генов HLA и высоким риском развития определенных болезней. Например, более 90% пациентов с анкилозирующим спондилоартритом, тяжелой аутоиммунной патологией позвоночника имеют ген HLA-B27.
Поскольку HLA определяет гистосовместимость, необходимо, чтобы у донора и реципиента при трансплантации органа или ткани было соответствие по HLA. Карта пациента по HLA называется «Jull house» («полный дом»)и включает данные относительно двух аллелей каждого вида молекул (например, HLA-A, HLA-B, HLA-DR и др.). Сенсибилизация белками HLA в прошлом (при гемотрансфузиях, трансплантациях или беременности) может приводить к острому отторжению пересаживаемого трансплантата или тромбоцитопении при переливании крови, поэтому необходимо обязательное тестирование на наличие антител против HLA. Типирование HLA может служить дополнительным критерием для диагностики таких болезней, как анкилозирующий спондилоартрит, диабет, целиакия, гемохроматоз, псориаз и нарколепсия, при которых известна высокая степень связи с определенными гаплотипами HLA.
Дата добавления: 2015-01-29; просмотров: 1675;
