Уравнение изотермы химической реакции
Для решения принципиальной возможности или невозможности того или иного физико-химического процесса необходимо, прежде всего, установить, является ли интересующая нас система при данных условиях (при данных температуре, давлении, концентрации) равновесной или неравновесной. Если система неравновесна, следует выяснить, по какую сторону от равновесия находится система и насколько она удалена от него.
В изобарно-изотермических процессах состояние равновесия или степень отклонения от него определяют по знаку и величине изменения изобарного потенциала ΔG, которое рассчитывают по уравнению изотермы химической реакции или уравнению Вант - Гоффа:
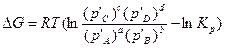 , (39)
, (39)
где 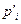 - парциальные давления компонентов, относящиеся к произвольно заданному составу реакционной системы, то есть фактические парциальные давления в данном состоянии; ΔG =G2 – G1 – изменение изобарного потенциала при определенной температуре и произвольно выбранных концентрациях реагентов.
- парциальные давления компонентов, относящиеся к произвольно заданному составу реакционной системы, то есть фактические парциальные давления в данном состоянии; ΔG =G2 – G1 – изменение изобарного потенциала при определенной температуре и произвольно выбранных концентрациях реагентов.
Для изохорно-изотермических процессов состояние равновесия или степень отклонения от него определяют по знаку и величине изменения изохорного потенциала ΔF. Уравнение изотермы запишем, используя концентрации веществ:
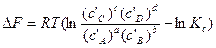 . (40)
. (40)
Так как в стандартном состоянии активности веществ принимают равными единице аi=1, то в общем случае стандартное изменение изобарного потенциала:
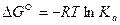 (41)
(41)
и 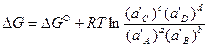 . (42)
. (42)
Знак ΔG показывает, по какую сторону от равновесия находится система в данном состоянии, и по нему можно судить о направлении процесса.
Если ΔG <0, это означает, что при данных температуре и давлении концентрации реагентов таковы, что вещества в левой части уравнения обладают большим значением изобарно-изотермического потенциала, чем вещества в правой части G1> G2. Процессы самопроизвольно идут только в сторону меньшего значения потенциала, и реакция будет протекать только вправо (прямое течение). Если ΔG >0, то в системе возможно обратное течение процесса – справа налево согласно записи уравнения химической реакции.
Абсолютная величина │ΔG│ тем больше, чем сильнее отличаются фактические и равновесные концентрации реагентов. Абсолютная величина │ΔG│ является мерой отклонения рассматриваемой системы от равновесия.
Эта же величина является мерой химического сродства, то есть способности веществ вступать между собой в химическое взаимодействие при определённых температуре, давлении и заданном соотношении концентрации реагентов.
Химическое сродство характеризует только стремление к взаимодействию, основанному на разности потенциалов, но ничего не говорит о возможности реализации процессов, об их скорости и пути протекания.
Для сопоставления химического сродства элементов в различных реакциях принимают, что все реагенты находятся в стандартном состоянии при данной температуре, то есть газы считаются идеальными и каждый из них находиться под давлением 1,01·105 Па (1атм), а конденсированные вещества в чистом виде берутся в их реальном устойчивом состоянии при той же температуре и при общем давлении 1,01·105 Па (1 атм).
Выбор стандартного состояния может быть произвольным. Важно, что при этом активности веществ принимаются равными единице аi=1.
Зная изменение изобарного потенциала процесса в стандартных условиях, можно определить константу равновесия химической реакции из уравнения (41):
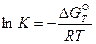 , (43)
, (43)
где 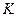 - константа равновесия химической реакции,
- константа равновесия химической реакции, 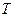 - абсолютная температура,
- абсолютная температура, 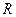 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Если 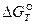 и R выражены в Дж/(моль·К), то уравнение имеет вид
и R выражены в Дж/(моль·К), то уравнение имеет вид
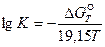 . (44)
. (44)
На практике часто используется уравнение, в котором изменение стандартного изобарного потенциала реакции выражено через изменения энтальпии и энтропии (29):
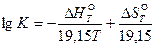 . (45)
. (45)
В состоянии равновесия 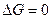 ,
, 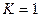 . Если
. Если 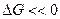 и
и 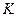 >>1 – реакция прямая. Если
>>1 – реакция прямая. Если 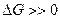 и
и 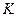 <<1 – реакция обратная.
<<1 – реакция обратная.
Дата добавления: 2015-01-29; просмотров: 1942;
