Химическое равновесие в гомогенной среде
Примером гомогенной среды может быть газовая смесь или различные жидкие растворы. Выражением условий химического равновесия для гомогенных систем является закон действующих масс или константы равновесия, согласно которому:
при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, причём каждое из них влияет на скорость в степени, равной стехиометрическому коэффициенту в уравнении реакции.
Пусть в гомогенной системе протекает реакция
аА+bВ↔сС+dD,
где а, b, с, d – стехиометрические коэффициенты или количество молей веществ А, В, С, D соответственно.
Стрелки в уравнении указывают на возможность протекания реакции в обоих направлениях с определенной скоростью.
Если в начальный период скорость протекания реакции в прямом υ1и обратном υ2 направлении неодинаковы, то по мере приближения к состоянию равновесия они становятся близкими друг к другу. При равновесии υ1= υ2.
Согласно закону действующих масс
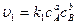 ,
,
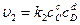 ,
,
где сА, сB, сC, сD – концентрации веществ, выраженные в молях на литр; k1, k2 – константы скоростей реакции.
При равновесии 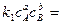
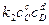 , следовательно, константа равновесия реакции
, следовательно, константа равновесия реакции
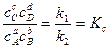 (34)
(34)
Если в реакции учувствуют газообразные вещества, то константа равновесия реакции может быть выражена через парциальные давления соответствующих веществ:
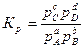 . (35)
. (35)
Кс и Кр связаны между собой зависимостью
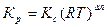 , (36)
, (36)
где Δn = (c+d-a-b) – изменение числа молей веществ, участвующих в реакции; R – универсальная газовая постоянная.
При ∆n=0 Кр=Кс.
Закон действующих масс применим только для идеальных газов и разбавленных растворов, для которых произведение равновесных концентраций является функцией только температуры К=f(T).
Для реальных газов и растворов закон действующих масс применим, если вместо давления и концентрации используются соответственно фугитивности или активности, которые зависят не только от температуры, но и от давления и состава газовой смеси или раствора.
Дата добавления: 2015-01-29; просмотров: 992;
