Критические и приведенные параметры газов
При изменении величины давления или температуры все газы могут быть превращены в жидкость или из жидкости в пар. Для каждого газа существует определенная температура, выше которой, несмотря на применение любого высокого давления, он не может быть переведен в жидкое состояние. Эта температура называется критической, а давление, необходимое для сжижения газа при этой температуре, критическим.
Иными словами, критическая температура чистых веществ - это та максимальная температура, при которой жидкая и паровая фазы еще могут существовать в равновесии. Давление паров при этой температуре называется критическим давлением, а объем единицы плотности вещества критическим объемом.
Понятие о критической температуре впервые было предложено в 1861 г. Д. И. Менделеевым, который понимал под ней температуру, при которой исчезают силы сцепления между молекулами жидкости, и она, независимо от давления, превращается в газ.
Приведенные выше определения критических параметров справедливы для индивидуальных газов.Технические газы в большинстве случаев представляют собой сложные смеси, критическая температура которых всегда выше критической температуры самого низкокипящего компонента и ниже критической температуры высококипящих компонентов.
Критические параметры газовой смеси могут быть подсчитаны по правилу смешения (закону аддитивности), т.е. путем суммирования произведения абсолютных значений критического параметра отдельных компонентов, входящих в газовую смесь, на их мольную концентрацию.
Например, для температур:
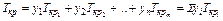 ,
,
гдеТКР1, Ткр2,..., ТКРп - критические температуры компонентов, входящих в газовую смесь; y1, y2,…, yn— объемные или весовые концентрации компонентов газовой смеси в долях единицы.
Аналогично определяются и другие критические параметры.
Подсчитанные по правилу смешения, критические параметры газовой смеси получили названия псевдокритических, или среднекритических.
Отношение абсолютных значений физических констант вещества к их критическим параметрам получило название приведенных параметров.
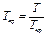 ;
; 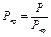 ;
; 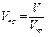 .
.
Эти уравнения были названы обобщенными уравнениями состояния. Для гелия, водорода и неона приведенные температуру и давление следует определять по уравнению:
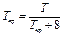 ;
; 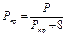 .
.
Экспериментально было установлено, что все газы при одинаковых приведенных температурах и давлениях имеют одинаковый приведенный объём, т.е. приведенный объем газов есть функция приведенной температуры и приведенного давления:
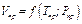 . (1.13)
. (1.13)
Указанная выше закономерность получила наименование закона соответственных состояний.
Дата добавления: 2015-01-29; просмотров: 6425;
