Закон Дальтона
В 1802 г. английский химик и физик Джон Дальтон (1766— 1844) опубликовал закон парциальных давлений, согласно которому давление газовой смеси равно сумме давлений, производимых каждым компонентом в отдельности, т.е.
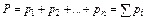 .
.
Таким образом, в. смеси газов каждый компонент ведет себя независимо от других, а следовательно, он сохраняет все свои физические свойства независимо от количества компонентов, находящихся в этой смеси.
Каждый из компонентов, входящих в газовую смесь, имеет свою упругость (давление), которая называется парциальным давлением. Поэтому закон Дальтона можно сформулировать еще так: общее давление смеси газов равно сумме парциальных давлений компонентов, входящих в эту смесь.
Объём каждого компонента равен общему объему смеси, но, занимая весь объем смеси, каждый компонент имеет свою упругость, т. е. находится под своим парциальным давлением.
Парциальный объем, т. е. объем каждого компонента, приведенный к общему давлению, можно определить по закону Бойля-Мариотта, а именно:
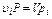
откуда
 .
.
Сумма парциальных объемов равна общему объему
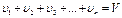 ,
,
что видно из следующего уравнения:
 .
.
Из приведенного выше уравнения можно определить не только парциальный объем, но и парциальное давление:
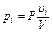 .
.
Отношение 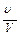 , т. е. отношение парциального объема к общему объему, есть объемная или молекулярная концентрация, которую для газовой и паровой фаз обычно обозначают буквой у. Таким образом, парциальное давление компонента
, т. е. отношение парциального объема к общему объему, есть объемная или молекулярная концентрация, которую для газовой и паровой фаз обычно обозначают буквой у. Таким образом, парциальное давление компонента 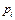 в газовой или паровой фазе равно произведению его объемной или молекулярной (молярной) концентрации
в газовой или паровой фазе равно произведению его объемной или молекулярной (молярной) концентрации 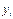 , на общее давление (P):
, на общее давление (P):
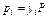 .
.
Объемная концентрация компонента в газовой смеси равна
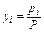 .
.
Дата добавления: 2015-01-29; просмотров: 1440;
