Рецепторы стероидов
На способность стероидных гормонов регулировать ядерные процессы вначале указывали данные об увеличении синтеза РНК в матке [77] и предстательной железе [77] под влиянием соответственно эстрогенов и андрогенов. Впоследствии было показано, что все классы стероидных гормонов после введения их с тритиевой меткой накапливаются в ядрах соответствующих клеток-мишеней. Так, было обнаружено, что меченые эстрогены концентрируются в женских репродуктивных тканях, которые характеризуются высоким содержанием цитоплазматических рецепторов эстрадиола в. отличие от малого их количества, присутствующего в других тканях [79]. Рецепторы эстрогенов локализуются преимущественно в цитозоле матки кастрированных или неполовозрелых крыс, а после воздействия эстрогенов in vivo или in vitro транслоцируются в ядро [80]. Б дальнейшем оказалось, что стероиды всех классов вначале связываются со специфическими цитоплазматическими рецепторами, которые подвергаются активации и транслокации в ядро.
Цитоплазматические рецепторы эстрогенов при центрифугировании в градиенте плотности в присутствии 0,4 М КС1 обнаруживают свойства 4S белка, который при активации и транслокации в ядро превращается в 58-форму. Способность антиэстрогенов, таких, как кломифен и нафоксидин, снижать поглощение эстрогенов и сопутствующую этому реакцию роста матки указывает на значение рецепторного связывания в качестве раннего этапа действия эстрогенов. Известно, что рецепторы эстрогенов, первоначально-идентифицированные в цитозоле матки как белки с константой седиментации в низкосолевой среде 8—9S, при внутриклеточных условиях ионной силы существуют в 4S-форме [80]. При воздействии эстрогенов и нагревании цитозольные 4S-рецепторы превращаются в 5S-форму, обнаруживающую выраженное сродство к изолированным ядрам и хроматину. Природа 4S—5S превращения не ясна, но этот процесс зависит, по-видимому, не просто от конформационного изменения, а предполагает какую-то форму вызываемой гормоном димеризации [81]. Такой же тип цитоплазматических рецепторов и процесса транслокации в ядро наблюдали во многих эстрогензависимых тканях, в том числе в передней доле гипофиза и опухоли молочной железы. Ткань гормонзависимого рака молочной железы человека поглощает больше эстрогенов, чем ткань автономных опухолей, и содержание рецепторов эстрогенов в раковой ткани можно использовать для прогнозирования последующей реакции на кастрацию у больных с далеко зашедшим раком молочной железы.
Очистка цитозольных и ядерных эстрогенрецепторных комплексов вызывала большие трудности из-за их нестабильности и склонности к агрегированию. Однако цитозольные рецепторы стабилизируются в присутствии кальция и при низкой или высокой концентрации соли приобретают свойства 4,5S-форм. Ядерные эстрадиолрецепторные комплексы в процессе очистки теряют склонность к агрегированию и были выделены в виде 4,8S-белка с молекулярной массой 66000. Позднее с помощью иммунизации кроликов, коз и мышей очищенными препаратами ядерных рецепторов эстрадиола из матки телок были получены антитела к рецепторам эстрогенов. Эти антитела давали перекрестную реакцию с рецепторами из эстрогенчувствительных тканей и опухолей животных нескольких видов [82]. Одной из многих возможных областей применения таких антител является разработка иммунохимических методов определения рецепторов эстрогенов в тканях-мишенях, включая рак молочной железы у человека, для оценки их дстрогенной зависимости.
Рецепторы прогестерона присутствуют в женских репродуктивных тканях, в том числе яйцеводах, матке и влагалище, и охарактеризованы как 6,5—8S-цитозольные компоненты, которые диссоциируют на 4S-форму в присутствии соли, подобно рецепторам эстрогенов. Эстрогены оказывают выраженное влияние на характер и число прогестероновых рецепторов. Комплексы прогестерона с рецепторами из матки нестимулированных крыс седиментируют при низкой ионной силе с константой 4—5S, а после воздействия эстрогенов превращаются в более крупные компоненты (6,5—8S),[83]. Кроме того, в ходе эстрального цикла в проэструсе преобладают крупные цитозольные формы (6,7S), а в диэструсе — меньшие (4, 5S) формы, что согласуется с эффектами вводимых эстрогенов. Концентрация прогестероновых рецепторов в репродуктивных тканях под влиянием эстрогенов заметно повышается. Число связывающих мест в матке животных достигает максимума в проэструсе, а у человека в гиперпластическом эндометрии выше, чем во время пролиферативной и секреторной фаз менструального цикла.
Свойства прогестероновых рецепторов интенсивно изучались на яйцеводах незрелых цыплят, в которых эстрогены способствуют дифференцировке клеток канальцевых желез, секретирующих крупные протеины яичного белка, овальбумин, кональбумин и ли-зоцим, и стимулируют образование прогестероновых рецепторов. После элиминации эстрогенов синтез овальбумина прекращается, но может возобновляться после воздействия либо эстрогенами, либо прогестероном. Воздействие прогестероном вызывает также дифференцировку эпителия в бокаловидные клетки, синтезирующие авидин — белок яйцеводов, с чрезвычайно высоким сродством связывающий биотин. Цитоплазматические прогестероновые рецепторы седиментируют как 3,8S-комплексы и в присутствии прогестерона подвергаются транслокации в ядро в ходе зависимого от температуры процесса. Ядерные прогестеронрецепторные комплексы представляют собой 4S-белки, аналогичные таковым в цитозоле, и не обнаруживают изменения седиментационных свойств, что характерно для ядерных эстрогеновых рецепторов, которые в процессе активации и транслокации превращаются из 4S в 5S-форму. Цитозольный 8S-рецептор прогестерона был очищен и разделен на два 4S-компонента с молекулярными массами 110000 (А) и 117 000 (В). Было установлено, что компонент В специфически связывается с хроматином клеток яйцеводов и может определять специфичность тканевого связывания активированного прогестеронового рецептора [84].
Рецепторы андрогенов были идентифицированы в мужских половых органах и акцессорных половых тканях в исследованиях по связыванию меченных тритием тестостерона и дигидротестостерона. Рецепторы андрогенов, присутствующие в цитозоле предстательной железы, семенных пузырьков и других мужских тканей, седиментируют как 8—9S-формы при низкой ионной силе и как 4S-формы в присутствии соли. Подобно рецепторам эстрогенов и прогестерона, цитоплазматические андрогенрецепторные комплексы подвергаются зависимой от температуры транслокации в ядро, откуда их можно экстрагировать в виде 3S-формы [85]. Важной особенностью андрогенрецепторной системы в мужских акцессорных половых тканях является необходимость превращения тестостерона в дигидротестостерон, предшествующего связыванию с рецептором и его транслокации. Таким образом, 3S-ядерный андрогенрецепторный комплекс в этих тканях содержит не тестостерон, а дигидротестостерон, образующийся под действием 5a-редуктазы до связывания с цитоплазматическими рецепторами. Необходимость ферментативного превращения андрогенных гормонов в дигидротестостерон для активации рецепторов во многих мужских тканях-мишенях имеет отношение к некоторым формам генетически детерминированной резистентности к андрогенам. Синдром тестикулярной феминизации — крайняя форма мужского псевдогермафродитизма может обусловливаться как нарушением синтеза дигидротестостерона, так и рецепторным дефектом при действии андрогенов.
Сходный синдром у грызунов (Tfm) определяется дефектом андрогеновых рецепторов, а не нарушением восстановления тестостерона в дигидротестостерон [86].
Глюкокортикоидные рецепторы первоначально были обнаружены в печеночных и лимфоидных клетках, а в настоящее время открыты в большинстве тканей млекопитающих, что согласуется с представлением о широко распространенном регуляторном влиянии кортизола и родственных кортикостероидов. В отсутствие стероида рецепторы нестабильны и проявляют высокое сродство и стереоспецифичность к природным глюкокортикоидам и их активным синтетическим аналогам, таким, как дексаметазон и триамсинолон. Подобно другим стероидрецепторным комплексам, глюкодюртикоид-рецепторный комплекс подвергается быстрой температурной активации с приобретением способности транслоцироваться в ядро и связываться с хроматином. Глюкокортикоид-рецепторные комплексы седиментируют как 7S-формы при низкой ионной силе и превращаются в 48-форму при высокой ионной силе. Активация стероидрецепторного комплекса не изменяет его седиментационных свойств, но вызывает снижение изоэлектрической точки, что обусловливает изменение подвижности на ионообменных средах (фосфоцеллюлозе и ДЭАЭ-целлюлозе), а также повышение сродства к ДНК и хроматину [87]. Такие изменения ионных свойств позволяют разделять активированные и неактивированные комплексы на ДЭАЭ-целлюлозе. Анализ цитозоля клеток вилочковой железы с помощью этой методики показал, что неактивированные комплексы присутствуют только в 1-ю минуту после воздействия дексаметазоном, а в течение следующих нескольких минут быстро превращаются в активированные [88].
Альдостероновые рецепторы были обнаружены в тканях-мишенях минералокортикоидов, таких, как почки, мочевой пузырь, околоушная железа и кишечник. В секреторном эпителии такие рецепторы крайне лабильны и с трудом поддаются анализу, причем их изучение осложняется присутствием в тканях-мишенях других рецепторов для структурно и биологически сходных глюкокортикоидов [89]. Сравнительное сродство двух классов рецепторов к альдостерону и глюкокортикоидам таково, что альдостерон в низких и физиологических концентрациях преимущественно связывается с I (минералокортикоидным) типом связывающих мест, а в более высоких концентрациях со все большим количеством глюкокортикоидных рецепторов. И наоборот, глюкокортикоиды в физиологических концентрациях лишены минералокортикоидной активности, но в сверхфизиологических количествах (эндо- или экзогенных) связываются с I типом рецепторов и оказывают сользадерживающее действие [73]. При исследовании с помощью методики, позволяющей нивелировать вмешательство глюкокортикоидных рецепторов, оказалось, что альдостероновые рецепторы связывают минералокортикоиды в соответствии с их биологической активностью и реагируют с кортизолом (при достаточно высокой концентрации последнего), равно как и с более активными сользадерживающими стероидами — альдостероном и дезоксикортикостероном, Главные цитоплазматические альдостеронрецепторные комплексы седиментируют как 8,5S-формы при низкой ионной силе и как 4S-формы при высокой ионной силе [90]. Ядерные рецепторы, экстрагированные 0,3 М КСl, также седиментируют как 48-формы и подвергаются максимальной транслокации из цитозоля через 10 мин после инъекции альдостерона.
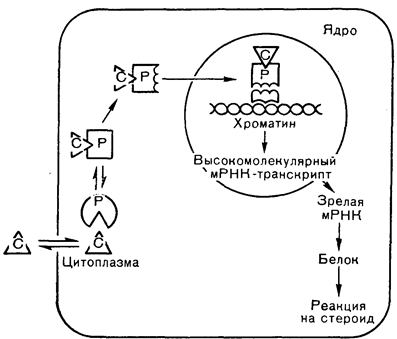
Рис. 4—26. Диаграмма этапов действия стероидных гормонов. Активация внутриклеточных рецепторов стероидными гормонами сменяется ядерным связыванием комплекса и стимуляцией синтеза мРНК (Baxter, McLeod [69] в модификации). С — стероид, Р — рецептор.
Дата добавления: 2015-01-19; просмотров: 2069;
