Механизмы действия кальция как второго медиатора: кальмодулин
Биологические эффекты кальция реализуются с помощью трех главных механизмов: взаимодействия с сократительными элементами, изменения проницаемости мембран для ионов и регуляции активности ферментов. Влияние кальция на аденнлат- и гуанилатциклазу и фосфодиэстеразу играет существенную роль в регуляции динамических уровней циклических нуклеотидов и в сопряжении двух внутриклеточных систем медиаторов за счет механизмов обратной связи, интегрирующих биологическую активность этих систем (рис. 4—15).
Основной прогресс в понимании эффектов кальция был связан с открытием кальцийзависимого регуляторного белка, или кальмодулина, и выяснением его структурного и функционального сходства с тропонином С [55]. При мышечном сокращении кальций связывается тропонином и образующийся комплекс одновременно облегчает взаимодействие между актином и миозином и активирует миозиновую АТФазу, что необходимо для повторения актино-миозинового взаимодействия. Присутствие актина в несокращающихся клетках указывает на роль сократительных элементов. в клеточной мобильности, движении клеточных органелл, высвобождении гранул и эндоцитозе. Поскольку содержащие актин микрофиламенты часто концентрируются под плазматической мембраной и иногда оказываются прикрепленными к мембранным белкам, они могли бы служить фактором, опосредующим эффекты кальция на подвижность клеток, текучесть мембраны и перегруппировку или интернализацию связанных с мембраной белков и ассоциированных с ними наружных лигандов.

Рис.4—15. Общая связь между главными межклеточными и внутриклеточными регуляторными лигандами и их рецепторными белками, т. е. пептидными гормонами, кальцием и циклическими нуклеотидмонофосфатами (цНМФ). В3аимодействие между этими медиаторами затрагивают их метаболизм и функции, равно как и их комплементарные роли в отношении скорости, расстояния и продолжительности действия (Cheung f55] в модификации).
Хотя было показано, что многие клетки содержат широкую сеть актино- и миозиноподобных нитчатых белков, прикрепленных к внутренней поверхности плазматической мембраны и часто к. мембранам секреторных гранул, присутствие характерного для мышцы тропонинового компонента в несокращающихся клетках было установлено не сразу. Недавнее открытие тропониноподобных кальцийсвязывающих белков в клетках многих типов привело к созданию представления об общем кальцийзависимом регуляторном (КЗР) белке, или кальмодулине. В общем, кальмодулин, по-видимому, играет роль, аналогичную тропонину С, опосредуя кальциевые эффекты в несокращающихся тканях. Присутствующий в; этих тканях кальмодулин иногда связан с сетью микронитей, а в других случаях тесно ассоциирован с кальцийрегулируемыми ферментами в виде прочно связанной или входящей в их состав субъединицы. Помимо того, что он служит внутриклеточным рецептором кальция, кальмодулин влияет на транспорт кальция и; кальциевую регуляцию уровня циклических нуклеотидов и метаболизма гликогена, а также регуляцию таких процессов, как секреция и клеточная подвижность. Кальмодулин является также динамическим компонентом митотического аппарата, где он может регулировать полимеризацию микротрубочек, активность актомиозина и мембранных кальциевых насосов [56а].
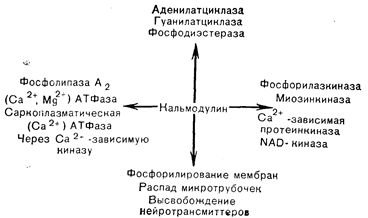
Рис. 4—16. Ферменты и клеточные процессы, регулируемые кальмодулином (Cheung в модификации).
После индентификации кальмодулина в качестве термостабильного регуляторного белка нескольких ферментов головного мозга он был выделен из многих тканей, очищен и охарактеризован как рецепторных белок с молекулярной массой 17 000, обладающий высокой специфичностью и сродством связывания Са2+. Каждая молекула кальмодулина содержит 4 кальцийсвязывающих участка, насыщение которых приводит к изменению конформации белка, приобретающего преимущественно a-спиральную конфигурацию, придающую кальмодулину способность регулировать зависимые от пего ферментные системы. Белок состоит из 148 аминокислот с высоким содержанием фенилаланина и кислых остатков и обнаруживает значительную гомологию последовательности с тропонином С из скелетной и сердечной мышцы. Присутствие кальмодулиноподобных белков во многих тканях млекопитающих и беспозвоночных указывает на вероятность опосредования физиологических эффектов кальция такими рецепторными белками, которые в свою очередь регулируют активность отдельных ферментов.
Значение кальмодулина как медиатора кальциевых эффектов впервые было установлено на ткани головного мозга, где выяснилось, что активация кальцийзависимой фосфодиэстеразы требует присутствия модуляторного белка. К ферментам, активация которых кальцием, как известно, в настоящее время, зависит от кальмодулина, относятся аденилатциклаза и фосфодиэстераза головного мозга, Ca/Mg-АТФаза мембраны эритроцитов, фосфорилазкиназа и киназа легкой цепи миозина (рис. 4—16). Как активация фермента модуляторным белком, так и связывание модулятора с ферментом зависят от присутствия кальция. При повышении концентрации кальция модуляторный белок связывает его и подвергается конформационному изменению, переходя в активное состояние, в котором он и связывается с ферментом, повышая его каталитическую активность. Не исключено, что при взаимодействии кальмодулина с разными регулируемыми системами степень насыщения 4 кальцийсвязывающих участков неодинакова; это может помочь объяснить расхождение его биологических эффектов. Роль кальмодулина в фосфорилировании киназы легких цепей миозина может быть связана с регуляцией сокращения гладких мышц (рис. 4—17). Насыщение b-рецепторов адреналином и стимуляция образования цАМФ приводит к активации протеинкиназы и фосфорилированию миозинкиназы, что ослабляет связывание кальмодулина. При низком уровне кальмодулина миозинкиназа менее активна и может преобладать активность фосфатазы, что обусловит сохранение меньшего числа молекул миозина в фосфорилированном состоянии. Вследствие этого не возникает взаимодействия между актином и миозином, и гладкая мышца расслабляется.
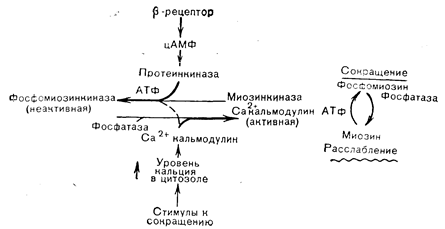
Рис. 4—17. Схема механизма регуляции сокращения гладкой мышцы под влиянием кальция и цАМФ. Доступность Са2+-кальмодулина определяет баланс между фосфорилированной (неактивной) и дефосфорилированной (потенциально активной) миозинкиназой. Фосфорилированная киназа связывает кальмодулин с более низким сродством, чем нефосфорилированный фермент. В связи с этим при одной и той же концентрации кальмодулина фосфорилированная киназа неактивна, а нефосфорилированная киназа находится в активной форме (Conti, Adelstein [56] в модификации).
Позднее в головном мозге был идентифицирован белок, связывающий кальмодулин и ингибирующий фосфодиэстеразу. Этот так называемый модуляторный связывающий белок может представлять собой еще один регуляторный фактор в системе гомеостаза кальция либо являться другим кальмодулинрегулируемым ферментом или, возможно, общей связывающей субъединицей кальмодулинрегулируемых ферментов. Относительно малое количество этого белка, присутствующего в мозге, указывает на большую вероятность его функционирования в качестве фермента или субъединицы.
Дата добавления: 2015-01-19; просмотров: 3430;
