РЕЦЕПТОРЫ ПЕПТИДНЫХ ГОРМОНОВ И КОМПОНЕНТЫ МЕМБРАНЫ
Хотя термин «рецептор» удобен для описания связывающих компонентов мембраны, с которыми взаимодействует гормон, использование его означает отсутствие сведений о специфических химических структурах, участвующих в реакции связывания. Если взаимодействующий участок вещества или лиганда известен, то точнее было бы при описании использовать его структуру, а не термин «рецептор». Рецепторы можно характеризовать по их специфической «узнающей» и связывающей функциям или, более широко, по тем изменениям, которые приводят к развертыванию специфической биологической реакции. Для объяснения механизмов, с помощью которых связывание с рецептором приводит к модификации мембранных ферментов, предложено несколько гипотез. На смену первоначальной точке зрения, согласно которой гормональные рецепторы структурно объединены с аденилатциклазой и играют роль регуляторной субъединицы фермента, пришли другие, точнее соответствующие данным о жидкой природе клеточных мембран.
Гипотеза мобильного рецептора, предложенная для объяснения механизма модуляции аденилатциклазы в клеточной мембране гормонрецепторным взаимодействием [10], основана на предположении, что рецепторные и ферментные белки представляют собой отдельные и разные молекулы (рис. 4—3). Считают, что связывание гормона с рецептором повышает сродство последнего к другим мембранным компонентам, участвующим в активации аденилатциклазы. Такая двухстепенная модель гормонрецепторного взаимодействия с аденилатциклазой согласуется с возможностью латеральной диффузии молекул рецепторов и фермента в жидком матриксе плазматической мембраны. Она объясняет также отсутствие аддитивности в активации аденилатциклазы многочисленными гормонами в определенных клетках и модуляцию независимых мембранных процессов одним гормоном, если предположить, что его комплекс с рецептором обладает сродством не к одной, а к нескольким регуляторным молекулам. Мобильность гормональных рецепторов в жидком матриксе мембраны могла бы также иметь значение для активации аденилатциклазы в эпителиальных клетках, обладающих морфологической полярностью, например в кишечнике, почках, печени и мочевом пузыре. Наконец, конкурентные антагонисты пептидных гормонов представляются молекулами, сохраняющими сродство связывания с рецепторами, но лишенные способности вызывать изменения конформации и реактивности последних, необходимые для активации аденилатциклазы.
Хотя рецепторные места для гормонов, по-видимому, физически отделены от аденилатциклазы, эти две молекулы обладают очевидной тесной функциональной связью, подтверждающей предположения о рецепторе как о регуляторном участке аденилатциклазного комплекса. В некоторых тканях соответствие между концентрацией гормональных рецепторов и активностью аденилатциклазы свидетельствует о существовании тесно связанного рецепторциклазного комплекса в мембранах клеток-мишеней. Зависимость гормональной активации аденилатциклазы от фосфо-липидов, наблюдаемая в некоторых мембранных и солюбилизированных препаратах, указывает на необходимость сопрягающего компонента липидной природы для ассоциации этих двух активностей. Изучение взаимоотношений между специфическими гормональными рецепторами и активностью аденилатциклазы в разных физиологических условиях и на разных стадиях развития также выявило тесную корреляцию между обоими параметрами. Так, появление рецепторов гонадотропина в семенниках плода тесно связано с приобретением клетками способности реагировать изменением уровня цАМФ на стимуляцию ЛГ и способности синтезировать тестостерон [11]. Более того, десенситизация клеток-мишеней путем воздействия агонистов часто сопровождается одновременной утратой гормончувствительной аденилатциклазы ц гормональных рецепторов. Опыты с десенситизацией обнаружили также уменьшение общей активности имеющейся аденилатциклазы, что указывает на инактивацию значительной части аденилатциклазы при насыщении рецепторов гормонами. Такие временные и количественные корреляции между двумя активностями подчеркивают тесную физическую связь рецепторов пептидных гормонов с аденилатциклазой в клеточной мембране.
Более современные модели пытаются учитывать функциональную сложность аденилатциклазной системы, содержащей не менее трех участков, с которыми реагируют отдельные лиганды, изменяя активность фермента. К ним относятся участок, взаимодействующий с гормоном, каталитический или ферментативный участок, реагирующий с Mg-АТФ, и промежуточный регуляторный участок, взаимодействующий преимущественно с гуаниловыми нуклеотидами. Изучение влияния гуаниловых нуклеотидов на активацию печеночной аденилатциклазы глюкагоном показало, что аденилатциклазный комплекс существует в различных формах, которые могут переходить друг в друга при согласованном действии гормона и гуанилового нуклеотида [12]. После этого аналогичные эффекты ГТФ наблюдали на многих гормончувствительных тканях. Синтетические аналоги ГТФ, устойчивые к ферментативному гидролизу, также стимулируют большинство аденилатциклазных систем, что указывает на роль гуаниловых нуклеотидов в качестве аллостерических активаторов аденилатциклазы. Один из таких аналогов Gpp (NH) p активирует аденилатциклазу, взаимодействуя с тем же самым участком, с которым реагирует и ГТФ. В некоторых тканях связывание меченого Gpp (NH) p с клеточными мембранами коррелирует со степенью активации аденилатциклазы. Сочетанное воздействие гормона и-Gpp (NH) p вызывает длительную активацию аденилатциклазы,. причем в очень многих тканях животных Gpp (NH) p повышает как исходную, так и стимулированную гормоном активность этого фермента. Такие эффекты ГТФ и его аналогов свидетельствуют о том, что регуляция взаимодействия между нуклеотидами и каталитическим участком аденилатциклазы составляет общую» черту действия пептидных гормонов (рис. 4—4).
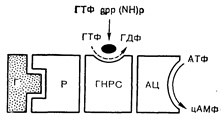
Рис. 4—4. Трехкомпонентная модель системы гормональный рецептор (Р) — аденилатциклаза. Гормон-рецепторный комплекс модулирует ГТФ-связывающую активность гуанилнуклеотид регуляторной субъединицы (ГНРС), в свою очередь активирующей аденилатциклазу (АЦ). Вызываемая гормоном (Г) активация комплекса ГТФ-ГНРС прекращается после гидролиза ГТФ на регуляторной субъединице или вблизи ее.
Действие гуаниловых нуклеотидов на аденилатциклазу часто сопровождается уменьшением связывающей способности соответствующих мест рецепции гормона. Как ГТФ, так и Gpp (NH) p-уменьшают сродство рецепторов к глюкагону, ангиотензину II и? катехоламинам, повышая константу скорости диссоциации гормон-рецепторного комплекса. Причина зависимости сродства рецепторов от действия гуаниловых нуклеотидов на активность фермента неясна, но влияние на связывание гормона могло бы представлять собой эффект, отдельный от активации аденилатциклазы.
Дата добавления: 2015-01-19; просмотров: 925;
