ХАРАКТЕРИСТИКА РЕЦЕПТОРОВ ПЕПТИДНЫХ ГОРМОНОВ
Исследования по связыванию, проводимые с помощью меченных радиоактивными атомами гормонов, позволили выявить некоторые характерные особенности, свойственные рецепторам многих пептидных гормонов. Универсальной чертой рецепторов является их способность распознавать и связывать соответствующие химические передатчики или гормоны в присутствии избытка молекул других видов. Это свойство легко проявляется в присутствии меченого гормона как избирательная реакция связывания с высоким сродством, которая приводит к образованию специфического гормонрецепторпого комплекса. За последние несколько лет такие взаимодействия наблюдались во многих гормончувствительных тканях. Во многих исследованиях наличие специфических связывающих мест в соответствующих тканях-мишенях принимали за доказательство присутствия гормональных рецепторов. Специфические связывающие места обнаружены также в клетках, которые не принято считать клетками-мишенями, например рецепторы инсулина и СТГ в лимфоцитах, рецепторы пролактина в печени и надпочечниках. Если учитывать, что правильное представление о рецепторах предполагает присутствие не только распознающего, но и запускающего реакцию компонента, то под такое определение не подходят рецепторы, для которых функциональная реакция пока остается не выясненной, а также рецепторы, которые выделены, солюбилизированы или расположены на нереагирующих клеточных компонентах. Таким образом, рецептор характеризуется специфическим связыванием лиганда и способностью передавать регуляторный сигнал, если даже дистальные элементы реакции отсутствуют или неидентифицированы.
Наиболее полное представление о рецепторе пептидного гормона включает двоякие функциональные свойства: поверхностное распознавание и трансляцию гормонрецепторного взаимодействия в специфическую биологическую реакцию. Независимо от того, является ли клеточной реакцией секреция пептидов, стероидогенез, сокращение или транспорт ионов, механизмы, опосредующие гормональный эффект, обычно включают изменение кальциевых потоков и метаболизма циклических нуклеотидов. На мембранных фракциях или интактных клетках многих тканей-мишеней наблюдали зависимость между связыванием гормона и биохимическими реакциями. Корреляция между насыщенностью рецепторов и активностью аденилатциклазы продемонстрирована на препаратах мембран многих гормончувствительных клеток, например клеток надпочечника в случае действия АКТГ, печени в случае действия глюкагона, почек при добавлении вазопрессина, эритроцитов птиц под влиянием катехоламинов, семенных канальцев в присутствии ФСГ, а также семенников и яичников в присутствии ЛГ и ХГЧ. В интактных тканях и изолированных клетках-мишенях связывание гормона также коррелировало с синтезом и высвобождением цАМФ [6]. Корреляцию связывания гормона с последующими клеточными реакциями наблюдали в отношении инсулина и окисления глюкозы в жировых клетках или транспорта аминокислот в тимоцитах, катехоламинов и транспорта натрия в эритроцитах,. ЛГ и продукции андрогенов семенниками, а также ангиотензина II и продукции альдостерона клетками клубочковой зоны надпочечника.
Иногда полагают, что гормональными рецепторами следует называть только те связывающие места ткани, которые можно отождествить с определенной биохимической реакцией. Однако» специфическое связывание меченых лигандов при условии соблюдения адекватных требований к методике его определения все-же является веским указанием на присутствие гормональных рецепторов. К таким требованиям относятся использование меченого гормона с отчетливой биологической активностью (полученного с помощью монойодирования или тритирования), точная оценка неспецифического связывания и исключение связывания с разрушающими или другими ферментативными активностями, присутствующими в тканевых фракциях. Большинство рецепторов пептидных гормонов проявляет высокую специфичность по отношению к биологически активным гормонам или их производным,, высокое сродство связывания, характеризующееся константами; равновесия ассоциации порядка 109—1011 М~1, и насыщаемость при относительно низких концентрациях гормона. Последние свойства соответствуют низкой концентрации гормональных рецепторов в ткани-мишени, которая составляет обычно всего несколько» тысяч мест на клетку. Реакция связывания всегда зависит от температуры, отличается высокой скоростью и в бесклеточных препаратах обычно обратима. В интактных клетках недавно был обнаружен необратимый компонент связывания гормона, и для тромбина и фактора роста эпидермиса (ФРЭ) было показано ковалентное присоединение лиганда к рецептору. Точное определение констант связывания и термодинамических свойств рецепторов часто затрудняется тем, что в опытах по связыванию, проводимых in vitro при физиологических температурах, может иметь место деградация гормона и рецептора. В условиях же, свойственных экспериментам in vivo, также трудно изучать кинетические и связывающие свойства рецепторов гормонов. На скорость ассоциации и диссоциации гормона большое влияние оказывает температура, а кругооборот молекул гормона в местах рецепции при характерных для организма условиях температуры и перфузии изучен недостаточно.
Белковая природа рецепторов полипептидных гормонов на плазматической мембране доказывается их расщеплением под действием различных протеолитических ферментов и пептидаз. На многие рецепторы влияет также фосфолипаза, что указывает на содержание в них важного фосфолипидного компонента или на роль ассоциации с фосфолипидной структурой мембраны в проявлении связывающей активности. Сообщалось, что некоторые рецепторы (для инсулина, ЛГ и ТТГ) содержат углеводные компоненты, иногда влияющие на связывающую активность. Отдельные рецепторы, такие, как рецепторы ЛГ, ФСГ и пролактина, для сохранения своей биологически активной конформации требуют присутствия дисульфидных групп.
Физико-химическая характеристика рецепторов пептидных гормонов затрудняется в результате их относительной нерастворимости, что свойственно многим белкам, содержащимся в мембране. В нескольких тканях из клеток и клеточных частиц удалось выделить рецепторы с помощью ограниченного ферментативного расщепления или инкубации в условиях, способствующих высвобождению поверхностных белков. Однако растворимые гормональные рецепторы для физико-химического анализа получают обычно путем экстрагирования из мембранных фракций и гомогенатов с помощью неионных детергентов, таких, как тритон Х-100 и люброл. Растворение плазматических мембран детергентами обычно приводит к утрате функционального сопряжения между гормонсвязывающими местами и ассоциированными с мембраной активностями, такими, как аденилатциклаза. Однако после удаления детергента наблюдается частичное восстановление гормонстимулируемой активности аденилатциклазы, а иногда после экстрагирования из тканевых фракций неионными детергентами солюбилизированная аденилатциклаза сохраняет чувствительность к гормону. В настоящее время из клеточных мембран экстрагированы специфические места связывания ацетилхолина, ангиотензина II, инсулина, глюкагона, ЛГ — ХГЧ, ФСГ, пролактина и» гормона роста [8].
Переформированные гормонрецепторные комплексы, образуемые путем насыщения тканей-мишеней меченым гормоном, можно легко экстрагировать с помощью обработки неионными детергентами. Такие гормонрецепторные комплексы обычно более стабильны в растворе, чем свободные, или «ненагруженные» рецепторы, и создают некоторые преимущества для физической характеристики. Яичниковые рецепторы ЛГ, предварительно меченные in vivo путем инъекции радиоактивного гонадотропина, обладают теми же самыми физическими свойствами, что и гормонрецепторные комплексы, образуемые путем метки нерастворимых фракций in vitro до солюбилизации. Некоторые свободные рецепторы и гормонрецепторные комплексы анализировали с помощью гельфильтрации и центрифугирования в градиенте плотности, и их молекулярная масса колебалась от 150 000 до 400 000.
Большинство солюбилизированных детергентом рецепторов при физическом анализе обнаруживают свойства молекул удлиненной формы с относительно большими для их констант седиментации (6,5—9,08) гидродинамическими радиусами в 6—7 нм. Эти свойства во многом обусловлены гликопротеиновой природой и выраженной асимметрией рецепторной молекулы, но отчасти могли бы объясняться и связыванием детергента с солюбилизированным белком. Очистку солюбилизированных детергентом гормональных рецепторов производили с помощью соответствующих методик фракционирования, а также аффинной хроматографии на гель-лигандных комплексах. Обычно такая очистка ограничена; главное исключение составляет холинергический рецепторный белок из ткани электрических органов некоторых рыб. С помощью аффинной хроматографии очищали также изолированные рецепторы инсулина, ЛГ — ХГЧ и пролактина. Хотя выход был весьма небольшим, но очищенные рецепторы оказались относительно стабильными и сохраняли высокое сродство и специфичность связывания гормональных лигандов. Этим методом тестикулярные рецепторы ЛГ были очищены примерно в 15000 раз, т. е. до 50% гомогенности белка. Наиболее высоко очищенный препарат рецептора ЛГ мигрирует при SDS-гель-электрофорезе в виде одного-компонента с молекулярной массой около 90 000, что свидетельствует о том, что экстрагированный детергентом рецептор представляет собой димер, состоящий из двух близких субъединиц [6]. Рецепторы пролактина и СТГ из ткани молочной железы и печени также были очищены с помощью аффинной хроматографии, причем было показано, что антитела, полученные к очищенным рецепторам пролактина, ингибируют биологическое действие этого гормона на его ткани-мишени [9]. Для анализа структурных особенностей, определяющих связывание гормона и активацию ассоциированных с мембраной ферментных систем, которые опосредуют его действие, необходима очистка больших количеств рецепторных мест.
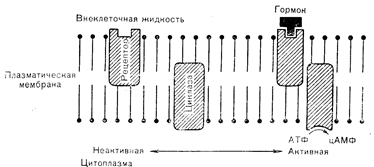
Рис. 4—3. «Плавающий рецептор»—двухстепенная физическая модель взаимодействия пептидного гормона с рецептором и активации аденилатциклазы в клеточной мембране.
Дата добавления: 2015-01-19; просмотров: 1089;
