Электрохимическая коррозия металлов
Коррозией металлов называют самопроизвольное разрушение металлов под действием различных окислителей из окружающей среды.
В реальных условиях коррозии обычно подвергаются технические металлы, содержащие примеси других металлов и неметаллических веществ.
Механизм электрохимической коррозии в таких металлах аналогичен механизму процессов, протекающих в короткозамкнутых гальванических элементах, в которых на участках с более отрицательным потенциалом идет процесс окисления (разрушение металлов), а на участках с более положительным потенциалом процесс восстановления окислителя (коррозионной среды).
Наиболее часто встречаются окислители (деполяризаторы):
· ионы водорода (коррозия с водородной деполяризацией)
2Н + + 2 ē = Н 2 (в кислой среде),
2Н2О + 2 ē = Н2 + 2ОН — (в нейтральной и щелочной средах);
· молекулы кислорода
O2 + 4 ē + 4Н + = 2Н2О (в кислой среде);
О2 +4 ē + 2Н2О = 4ОН — (в щелочной и нейтральной средах).
Методика рассмотрения работы гальванопары при электрохимической коррозии.
· Составляют схему гальванопары:
Ме1 / среда / Ме2 .
· Выписывают стандартные потенциалы металлов и окислителей коррозионной среды (табл.П.7), определяют восстановитель (меньший потенциал), окислитель (больший потенциал).
· Записывают уравнения процессов окисления и восстановления и суммарное уравнение окислительно-восстановительной реакции, протекающей при гальванокоррозии.
· Указывают направление движения электронов.
Пример 1.Гальванопара алюминий -железо в воде (среда нейтральная). В воде растворен кислород.
· Схема гальванопары Al / H2O, O2 / Fe
· Потенциалы 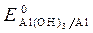 = -1,88 B;
= -1,88 B; 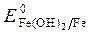 = -0,46B;
= -0,46B;
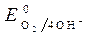 = + 0,814B.
= + 0,814B.
Восстановитель – Al, окислитель - О2.
 · Al(-): 4 Al - 3 ē + 3Н2О = Al(OH)3+ 3Н+ -процесс окисления;
· Al(-): 4 Al - 3 ē + 3Н2О = Al(OH)3+ 3Н+ -процесс окисления;
 Fe(+): 3 О2 + 4 ēē + 2Н2 О = 4ОН — -процесс восстановления
Fe(+): 3 О2 + 4 ēē + 2Н2 О = 4ОН — -процесс восстановления
4Al + 3О 2 + 6Н2О = 4Al(OH)3
· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:
ē

 (-) Al/ Fе (+) ē
(-) Al/ Fе (+) ē
 О2 , Н2О
О2 , Н2О
Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н+ ), если нарушена сплошность покрытия.
· Схема гальванопары:
Fe / Н2 О, О2, Н+ / Sn
· Потенциалы: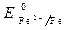 = -0,44 B;
= -0,44 B; 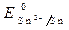 = -0,136 B;
= -0,136 B;
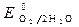 = + 1,228 B.
= + 1,228 B.
Восстановитель – железо, окислитель – кислород.
 ·Fe(-): 2 Fe - 2ē = Fe 2+ – процесс окисления
·Fe(-): 2 Fe - 2ē = Fe 2+ – процесс окисления
 Sn(+): 1 О2 + 4 ē + 4Н+ =2Н2О – процесс восстановления
Sn(+): 1 О2 + 4 ē + 4Н+ =2Н2О – процесс восстановления
2Fe + О2 + 4Н+ = 2Fe2+ + 2Н2О
2Fe + О2 + 4НCl = 2FeCl2 + 2Н2О
При нарушении целостности покрытия будет разрушаться Fe.
· Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом:
·
ē

 (-) Fe/ Sn (+) ē
(-) Fe/ Sn (+) ē
 О2 , Н+
О2 , Н+
Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
· Схема гальванопары: Al / КОН/ Fe
· Потенциалы: 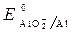 = -2,36 B;
= -2,36 B; 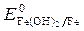 = -0,874 B;
= -0,874 B;
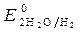 = - 0,827 B. Восстановитель -алюминий, окислитель - вода.
= - 0,827 B. Восстановитель -алюминий, окислитель - вода.
·  Al(-): 2 Al - 3ē + 4OH — = AlO2— + 2H2O – процесс окисления
Al(-): 2 Al - 3ē + 4OH — = AlO2— + 2H2O – процесс окисления
Fe(+): 3 2 H2O + 2 ē = 2 OH — + H2 – процесс восстановления 
2 Al + 2 OH — + 2H2O = 2 AlO2— + 3 H2
2 Al + 2 КOH + 2H2O = 2КAlO2 + 3 H2
Разрушается алюминий.
· Направление перемещения электронов в системе:
ē

 (-) Al/ Fe (+) ē
(-) Al/ Fe (+) ē
 H2O, KOH
H2O, KOH
Дата добавления: 2015-01-15; просмотров: 1146;
