Задание к подразделу 4.2
Используя потенциалы (табл. П.6, П.7, П.8), допишите уравнения реакций (по две для каждого варианта), составив к ним электронно-ионные схемы. Для реакций металлов с H2SO4 (конц.) и HNO3 значение потенциала окислителя более 1 В. Оцените практическую устойчивость металлов в данной среде.
| 281. а) Pb + KOH+ H2O + O2 б) Cu + H2SO4 (конц.) | 291. а)Al + HNO3 (разб.) б) Cr + NaOH + О2 |
| 282. а)Al + H2O + O2 б) Mg + HNO3 (разб.) | 292. а)Al + NaOH + H2O б) Cu + HNO3 (разб.) |
283. а)Al + HNO3 (конц.) 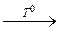 б) Sn + NaOH + O2 + H2O
б) Sn + NaOH + O2 + H2O
| 293. а)Al + H2SO4 (конц.) 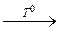 б) Sn + H2O + O2
б) Sn + H2O + O2
|
| 284. а)Al + NaOH + H2O + O2 б) Zn + H2SO4 (конц.) | 294. а)Cr + NaOH + H2O б) Be + HNO3 (разб.) |
285. а)Al+HNO3 (конц.) 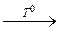 б) Zn + NaOH + H2O + O2
б) Zn + NaOH + H2O + O2
| 295. а)Fe + H2SO4 (конц.) 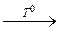 Fe3+
б) Al + H2O Fe3+
б) Al + H2O
|
| 286. а)Mg + H2O б) Zn + H2SO4 (разб.) + O2 | 296. а)Zn + HNO3 (конц.) б) Al + KOH+ H2O |
| 287. а)Fe + HNO3 (разб.) б) Zn + H2O + O2 | 297. а)Zn + H2SO4 (конц.) б) Co + NaOH+ H2O + O2 |
288. а)HNO3(разб.)+ Fe 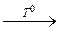 Fe3+
б) Zn + NaOH + H2O Fe3+
б) Zn + NaOH + H2O
| 298. а) Fe + HNO3(конц.) 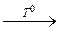 Fe3+
б) Al + H2O + O2 Fe3+
б) Al + H2O + O2
|
| 289. а)Zn + H2O + O2 б) Cu + H2SO4 (конц.) | 299. а)Zn + NaOH + H2O б) Cu + HNO3 (конц.) |
| 290. а)Zn + NaOH + H2O + O2 б) Cd + HNO3 (разб.) | 310. а)Zn + HNO3 (разб.) б) Cu + NaOH+ H2O + O2 |
Дата добавления: 2015-01-15; просмотров: 1462;
