Гальванические элементы. Гальваническими элементами называют устройства, в которых энергия окислительно-восстановительных реакций преобразуется непосредственно в электрическую.
Гальваническими элементами называют устройства, в которых энергия окислительно-восстановительных реакций преобразуется непосредственно в электрическую.
Методика рассмотрения работы гальванических элементов:
· Составляют схему гальванического элемента:
(–) Me1 / Me1n + // Me2 m+ / Me2 (+)
· По уравнению Нернста находят потенциалы электродов.
· Указывают движение электронов во внешней цепи: от электрода с меньшим потенциалом к электроду с более высоким потенциалом.
· Записывают уравнения электродных процессов, определяют характер этих процессов.
· Составляют суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе.
· Рассчитывают величину ЭДС гальванического элемента как разность потенциалов положительного и отрицательного электродов.
Пример 1. Гальванический элемент с водородным электродом.
· Схема Zn / ZnSO4 // H2SO4 , Н2 / Pt.
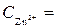 1 моль/л,
1 моль/л,  1 моль/л, Т = 298 К, P = 101,3 кПa .
1 моль/л, Т = 298 К, P = 101,3 кПa .
· Электродные потенциалы
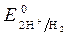 = 0 В ,
= 0 В , 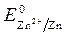 = - 0,76 В (при
= - 0,76 В (при 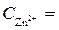 1 моль/л).
1 моль/л).
· Направление движения электронов во внутренней цепи - от цинкового электрода к водородному, так как потенциал цинкового электрода меньше.
ē 

(–) Zn / ZnSO 4 // H2SO4 , Н2 / Pt (+)
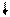 | |||
 |
SO42 -
· Уравнения электродных процессов:
Zn (-): Zn - 2 ē = Zn 2+ - процесс окисления;
Pt (+): 2Н ++ 2 ē = Н 2 - процесс восстановления.
· Суммарное уравнение:
Zn + 2Н + = Zn 2+ + Н 2 Zn + H2SO4 = ZnSO4 + Н 2
· Расчет величины ЭДС:
ЭДС = Е0Ox - Е0Red = 0 – (- 0,76) = 0,76 В.
Пример 2. Концентрационный гальванический элемент
Оба электрода из одного металла, но растворы солей, в которые погружены электроды, разной концентрации.
· Схема гальванического элемента:
Ni / NiSO 4(  = 10-4 моль/л)// NiSO 4 (
= 10-4 моль/л)// NiSO 4 ( 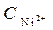 =1моль/л) / Ni
=1моль/л) / Ni
Стандартный электродный потенциал 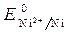 = - 0,25 В.
= - 0,25 В.
· Вычисление электродных потенциалов по уравнению Нернста:
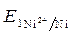 =
= 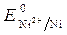 +
+ 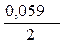 · lg
· lg 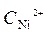 = -0,25 +
= -0,25 + 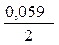 ·lg 10 -4 = -0,309 B.
·lg 10 -4 = -0,309 B.
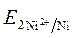 =
= 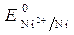 = - 0,25 B.
= - 0,25 B.
· Направление движения электронов по внешней цепи от Ni1 электрода к Ni2, так как 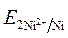 >
> 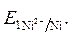
ē
 |
(-) Ni1 / NiSO4 (10-4 М) // NiSO4 (1 М) / Ni 2 (+)
 | |||
 |
SO42–
· Уравнения электродных полуреакций:
Ni1 (-): Ni - 2 ē = Ni 2+ - процесс окисления;
Ni2 (+): Ni2+ + 2 ē = Ni -процесс восстановления.
· Расчет величины ЭДС:
ЭДС = 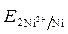 -
-  = - 0,25 - (- 0,309) = 0,059 В.
= - 0,25 - (- 0,309) = 0,059 В.
Дата добавления: 2015-01-15; просмотров: 1169;
