Анодные процессы
На аноде возможны процессы окисления:
· материала анода Ме - nē = Me n+
· молекул воды 2H2O - 4ē =О 2+ 4H +
· анионов солей
2Cl — - 2ē = Cl2 NO2— - 2ē + H2O = NO3— + 2H +
Анионы кислородосодержащих кислот, имеющие в своем составе атом
элемента в высшей степени окисления (SO4 2—, NO3— и др.), при электролизе водных растворов на аноде не разряжаются.
С учетом перенапряжения величину потенциала выделения кислорода нужно считать равной 1,8 В.
Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:
K2SO4 = 2K + + SO42—
 (-) Kатод K+ H2O(+) Aнод SO4 2— H2O
(-) Kатод K+ H2O(+) Aнод SO4 2— H2O
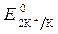 = - 2,92 B ;
= - 2,92 B ; 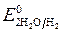 = -1 B. Сульфат-ионы не разряжаются.
= -1 B. Сульфат-ионы не разряжаются.
Так как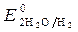 >
> 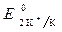 ,
, 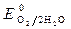 » 1,8 B.
» 1,8 B.
происходит восстановление воды: 2H2O - 4ē = O2 + 4 H +
2H2O +2ē = H 2+ 2 OH —
среда щелочная среда кислая
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами:
SnCl 2 = Sn 2+ + 2Cl —
 (-) Kатод Sn 2 +, H2O(+) Aнод Cl —, H2O
(-) Kатод Sn 2 +, H2O(+) Aнод Cl —, H2O
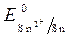 = - 0,136 B ;
= - 0,136 B ; 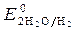 = -1B.
= -1B. 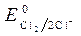 = 1,36 В ;
= 1,36 В ; 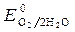 » 1,8 B.
» 1,8 B.
Так как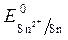 >
> 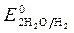 , Так как
, Так как 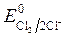 <
<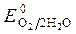 ,идет идет процесс восстановления процесс окисления ионов Сl -:
,идет идет процесс восстановления процесс окисления ионов Сl -:
ионов олова: Sn2+ + 2 ē = S n 2Cl — - 2 ē = Cl 2
Пример 3. Электролиз сульфата меди с медным анодом:
CuSO4 =Cu2+ + SO42-
 (-) Kатод Cu 2+ H2O (+) Aнод -Сu SO4 2— H2O
(-) Kатод Cu 2+ H2O (+) Aнод -Сu SO4 2— H2O
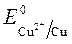 = + 0,34 B ;
= + 0,34 B ; 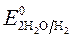 = -1 B.
= -1 B. 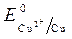 = + 0,34 B;
= + 0,34 B; 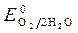 » 1,8 B.
» 1,8 B.
Так как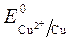 >
> 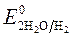 , Сульфат-ионы не разряжаются.
, Сульфат-ионы не разряжаются.
происходит восстановление Так как 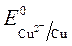 <
<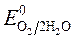 ,
,
ионов меди:Cu 2+ +2ē = Cu анод растворяется: Cu - 2ē = Cu 2+
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем (1834).
Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:
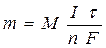 ,
,
где m - масса образовавшегося вещества , г;
М - молярная масса вещества, г/ моль;
n - количество электронов, участвующих в электродном процессе;
I - сила тока, А;
t - время электролиза, с;
F - константа Фарадея (96500 Кл/моль).
Для газообразных веществ, выделяющихся при электролизе, формулу использют в виде 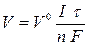 ,
,
где V- объем газа, выделяющегося на электроде; V 0 - объем 1 моль газообразного вещества при нормальных условиях (22,4 л/моль).
Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4А.
Дата добавления: 2015-01-15; просмотров: 1869;
