Решение. · Рассчитать стандартное изменение энтальпии реакции:
· Рассчитать стандартное изменение энтальпии реакции:
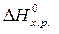 = å (n
= å (n 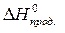 ) – å (m
) – å (m  )= 2
)= 2 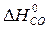 – (
– ( 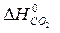 +
+ 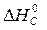 )=
)=
= 2×(–110,5) – (–393,5 + 0) = 172,5 кДж.
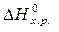 >0 – эндотермическая реакция.
>0 – эндотермическая реакция.
· Рассчитать стандартное изменение энтропии реакции:
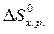 = å (n
= å (n 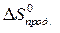 ) – å (m
) – å (m 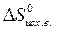 )=
)= 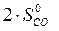 – (
– ( 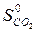 +
+  ) =
) =
=2·197,5 – (213,7 + 5,7) = 175,6 Дж/К = 175,6×10-3 кДж/К.
· Рассчитать стандартное изменение энергии Гиббса реакции:
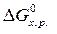 =
= 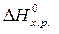 –
– 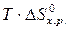 = 172,5 –298×175,6×10-3 = 120,2 кДж.
= 172,5 –298×175,6×10-3 = 120,2 кДж.
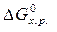 > 0, при Т = 298 К прямая реакция невозможна.
> 0, при Т = 298 К прямая реакция невозможна.
· Определить температуру, при которой устанавливается химическое равновесие.
Если пренебречь зависимостями 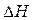 и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS »
и DS от температуры и считать их постоянными, можно рассчитать энергию Гиббса при нестандартной температуре Т: DG = DН – Т×DS » 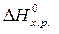 –
– 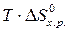
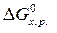 =
= 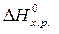 –
– 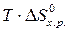 = 0 Þ Т =
= 0 Þ Т = 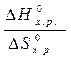 =
= 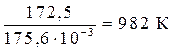
· Построить график зависимости 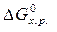 от Т.
от Т.
 |
Из графика видно, что в интервале температур 0 – 982 К DG > 0, следовательно, прямая реакция невозможна; выше 982 К DG < 0, т.е. самопроизвольно протекает прямая реакция.
Дата добавления: 2015-01-15; просмотров: 1092;
