Термодинамический метод рассмотрения химических процессов
Термодинамический подход заключается в рассмотрении начального и конечного состояний взаимодействующих веществ, при этом не учитываются механизм и скорость процесса.
Для описания систем используют набор термодинамических функций, основными из которых являются Н – энтальпия, S – энтропия, G – энергия Гиббса. В справочных таблицах приводят стандартные: энтальпии образования веществ 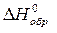 , кДж/моль, энтропии веществ
, кДж/моль, энтропии веществ 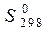 , Дж/(моль×К) (табл. П.1), энергии Гиббса образования веществ
, Дж/(моль×К) (табл. П.1), энергии Гиббса образования веществ 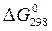 , кДж/моль. Стандартные условия:
, кДж/моль. Стандартные условия:
Т = 298 К; Р = 1,013×105 Па; вещества –химически чистые.
Энтальпийный эффект химической реакции определяют по закону Гесса и
следствию из него. Следствие из закона Гесса: изменение энтальпии химической реакции равно разности сумм энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрическихкоэффициентов:
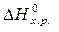 = å(n
= å(n 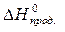 ) – å (m
) – å (m 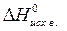 ),
),
где n, m – стехиометрические коэффициенты.
Аналогичным образом можно рассчитывать изменение и других функций – энтропии ( 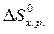 ), энергии Гиббса (
), энергии Гиббса ( 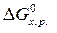 ).
).
В системах, находящихся при постоянных температуре и давлении, самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением энергии Гиббса (DG < 0). Если DG > 0 , реакция протекает в обратном направлении, а при DG = 0 система находится в состоянии химического равновесия.
Пример. Вычислить стандартные изменения энтальпии, энтропии, энергии Гиббса в реакции CO2(г) + С (графит) = 2CO(г). Определить температуру, при которой устанавливается химическое равновесие реакции, и сделать вывод о возможности протекания реакции в прямом направлении.
Дата добавления: 2015-01-15; просмотров: 852;
