Парциальные давления в газовой смеси. Закон Дальтона
Газовая смесь находится в состоянии равновесия, если концентрации компонентов и её параметры состояния во всём объёме имеют одинаковые значения. При этом температура всех газов, входящих в смесь, одинакова и равна температуре смеси Тсм.
В равновесном состоянии молекулы каждого газа рассеяны равномерно по всему объёму смеси, то есть имеют свою определённую концентрацию и, следовательно, своё давление рi, Па, которое называется парциальным. Оно определяется следующим образом.
Парциальное давление равно давлению данного компонента при условии, что он один занимает весь объём, предназначенный для смеси при температуре смеси Тсм.
По закону английского химика и физика Дальтона, сформулированному в 1801 году, давление смеси идеальных газов рсм равно сумме парциальных давлений её компонентов рi:
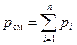 , (2)
, (2)
где n – число компонентов.
Выражение (2) также называется законом парциальных давлений.
3.3. Приведённый объём компонента газовой смеси. Закон Амага
По определению приведённым объёмом i-го компонента газовой смеси Vi, м3, называется объём, который один этот компонент мог бы занимать при условии, что его давление и температура будут равны давлению и температуре всей газовой смеси.
Закон французского физика Амага, сформулированный примерно в 1870 году, гласит: сумма приведённых объёмов всех компонентов смеси равна объёму смеси Vсм:
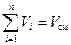 , м3. (3)
, м3. (3)
Дата добавления: 2015-03-19; просмотров: 1168;
