Химический состав газовой смеси
Химический состав газовой смеси может задаваться тремя различными способами.
Рассмотрим газовую смесь, состоящую из n компонентов. Смесь занимает объём Vсм, м3, имеет массу Мсм, кг, давление рсм, Па и температуру Тсм, К. Также число молей смеси равно Nсм, моль. При этом масса одного i-го компонента mi, кг, а число молей этого компонента νi, моль.
Очевидно, что:
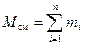 , (4)
, (4)
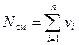 . (5)
. (5)
Используя для рассматриваемой смеси закон Дальтона (2) и Амага (3) можно записать:
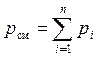 , (6)
, (6)
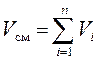 , (7)
, (7)
где рi – парциальное давление i-го компонента, Па; Vi – приведённый объём i-го компонента, м3.
Однозначно химический состав газовой смеси может быть задан либо массовыми, либо мольными, либо объёмными долями её компонентов:
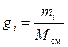 , (8)
, (8)
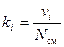 , (9)
, (9)
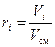 , (10)
, (10)
где gi, ki и ri – массовая, мольная и объёмная доли i-го компонента смеси соответственно (безразмерные величины).
Очевидно, что:
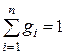 ,
, 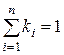 ,
, 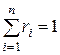 . (11)
. (11)
Часто на практике химический состав смеси задаётся не долями i-го компонента, а его процентами.
Например, в теплотехнике приближённо принимается, что сухой воздух состоит из 79 объёмных процентов азота и 21 объёмного процента кислорода.
Процент i-го компонента в смеси вычисляется путём умножения его доли на 100.
Для примера с сухим воздухом будем иметь:
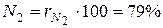 ,
, 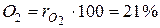 . (12)
. (12)
где 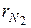 и
и 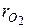 – объёмные доли азота и кислорода в сухом воздухе; N2 и О2 – обозначение объёмных процентов азота и кислорода соответственно, % (об.).
– объёмные доли азота и кислорода в сухом воздухе; N2 и О2 – обозначение объёмных процентов азота и кислорода соответственно, % (об.).
Примечание:
1) Мольные доли идеальной смеси численно равны объёмным долям: ki = ri. Докажем это.
Пользуясь определением объёмной доли (10) и законом Амага (3) можем записать:
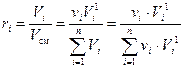 , (13)
, (13)
где Vi – приведённый объём i-го компонента, м3; νi – число молей i-го компонента, моль; 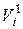 – объём одного моля i-го компонента при давлении смеси рсм и температуре смеси Тсм, м3/моль.
– объём одного моля i-го компонента при давлении смеси рсм и температуре смеси Тсм, м3/моль.
Из закона Авогадро (см. п. 2.3 данного приложения) следует, что при одинаковых температуре и давлении один моль любого газа (компонента смеси) занимает один и тот же объём. В частности, при Тсм и рсм это будет некоторый объём V1, м3.
Сказанное позволяет записать равенство:
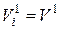 . (14)
. (14)
Подставляя (14) в (13) получаем требуемое:
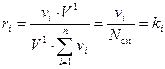 . (15)
. (15)
2) Объёмные доли компонентов газовой смеси можно рассчитать, зная их парциальные давления. Покажем это.
Рассмотрим i-ый компонент идеальной газовой смеси в двух различных состояниях: когда он находится при своём парциальном давлении рi; когда он занимает свой приведённый объём Vi.
Уравнение состояния идеального газа справедливо для любых его состояний, в частности, и для двух, названных выше.
В соответствии с этим, и учитывая определение удельного объёма, можем записать:
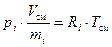 , (16)
, (16)
и
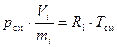 , (17)
, (17)
где Ri – газовая постоянная i-го компонента смеси, Дж/(кг·К).
После деления обоих частей (16) и (17) друг на друга получаем требуемое:
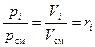 . (18)
. (18)
Из (18) видно, что парциальные давления компонентов смеси можно рассчитать по её химическому составу, при известном общем давлении смеси рсм:
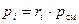 . (19)
. (19)
Дата добавления: 2015-03-19; просмотров: 1255;
