ОСНОВНІ ФАЗИ В СПЛАВАХ
Металевим сплавом називається речовина, отримане сплавкою двох або більш вихідних речовин, переважно металевих. Крім сплавки сплави одержують спіканням, електролізом і іншими способами.
Роль сплавів у техніку незмірно більш важлива, чим чистих металів. Це порозумівається тим, що сплави мають більш різноманітний комплекс властивостей, що у широких межах змінюються в залежності від складу сплаву. Механічні властивості багатьох сплавів на відміну від чистих металів дуже істотно можна змінювати термічним і іншим видами обробки.
Речовини, з яких утворений сплав, називаються компонентами сплаву. Як компоненти сплавів можуть бути як чисті елементи, так і стійкі хімічні сполуки. При кристалізації сплавів можуть утворитися наступні основні тверді фази: тверді розчини; хімічні сполуки; механічні суміші з компонентів, що сплавляються.
А. Тверді розчини. Тверді розчини є найбільше розповсюдженою фазою в металевих сплавах. Тому що термін «твердий розчин» для студентів незвичний, відзначимо, що принципова відмінність твердого розчину від рідкого в тім, що тверді розчини є кристалічними речовинами. Характерною рисою будівлі кристалів твердих розчинів є наявність у їхніх кристалічних ґратах різнорідних атомів при збереженні типу кристалічних ґрат розчинника. По характері розподілу атомів розчиненої речовини в кристалічних ґратах розчинника розрізняють два типи твердих розчинів: тверді розчини заміщення і твердих розчинів упровадження.
Тверді розчини заміщення. На мал. 6.1, а представлена схема кристалічних ґрат основного металу (розчинника). На схемі мал. 6.1,6 частина атомів розчинника заміщена атомами розчиненої речовини, що відповідає будівлі кристалічних ґрат твердого розчину заміщення.
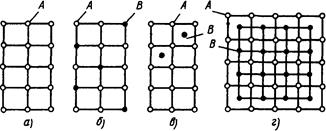
Рис. 4.1. Схеми будівлі кристалічних ґрат (кристалографічна площина):
а — основний метал (розчинник); б — твердий розчин заміщення; у — твердий розчин упровадження; м — хімічна сполука
Тверді розчини заміщення можуть бути з обмеженою і необмеженою розчинністю. При необмеженій розчинності кристалічні ґрати компонента розчинника в міру збільшення концентрації розчиненого компонента плавно переходять у кристалічні ґрати розчиненого компонента.
У твердих розчинах з обмеженою розчинністю можлива концентрація розчиненої речовини до визначеної межі. При подальшому підвищенні концентрації твердий розчин розпадається, і утворяться двохфазні суміші.
Зміна розчинності компонентів у твердому розчині зі зміною температури можна пояснити законами термодинаміки, а також зонною теорією кристалічних тел.
У твердих розчинах з необмеженою розчинністю можлива будь-яка концентрація (від 0 до 100%) розчиненої речовини.
Для утворення необмежених твердих розчинів відповідно до досліджень Юм-Розери необхідні: 1) ізоморфність (однотипність) кристалічних ґраток компонентів, що сплавляються; 2) близькість атомних радіусів компонентів, що не повинні відрізнятися більше чим на 8...13%; 3) близькість фізико-хімічних властивостей компонентів. Однак дотримання цих умов не завжди є достатнім, щоб компоненти, що сплавляються, утворили необмежені тверді розчини. У реальних сплавах частіше спостерігаються тверді розчини з обмеженою розчинністю.
Тверді розчини впровадження утворяться впровадженням атомів розчиненого компонента в попи кристалічних ґрат компонента-розчинника. Це можливо, якщо впроваджувані атоми мають малі розміри. Такими є атоми елементів, що знаходяться на початку періодичної системи Д. И. Менделєєва (Н, З, N. В). На мал. 6.1,у показана схема кристалічних ґрат твердого розчину впровадження.
Тверді розчини позначаються малими буквами грецького алфавіту.
Б. Хімічні сполуки. Характерними рисами хімічних сполук є: сталість складу, що може бути виражено формулою хімічної сполуки; наявність нового типу кристалічних ґрат, відмінного від типу ґрат компонентів, що сплавляються; яскраво виражені індивідуальні властивості; сталість температури кристалізації, як у чистих компонентів. На мал. 6.1, м показана схема кристалічних ґрат хімічної сполуки.
Хімічні сполуки металів поділяються на двох груп.
Одна група — це з'єднання з нормальною валентністю, що дають метали з типовими неметалами (ПРО, 8, З1 і т.д.). Такими з'єднаннями є оксиди, сульфіди, хлориди. У сплавах ці з'єднання присутні у виді так званих неметалічних включень.
Інша група — металеві з'єднання. З цієї групи найбільш важливими є фази впровадження й електронні з'єднання. Металеві з'єднання відрізняються розмаїтістю типів межатомных зв'язків (металевої, ковалентної, іонної) з перевагою металевого зв'язку. Завдяки цьому металеві з'єднання характеризуються металевим блиском, електропровідністю і в окремих випадках надпровідністю. Металеві з'єднання при звичайних температурах тверді і тендітні, однак при нагріванні до температур, що складають 70...90 % від температури плавлення, ці з'єднання дуже пластичні. Це пояснюють збільшенням при нагріванні частки металевої связ.і між атомами.
Металевими з'єднаннями є також з'єднання перехідних металів з вуглецем (карбіди), азотом (нітриди), воднем (гідриди), бором (бориды). Ці з'єднання можуть мати як дуже складну, так і прості ґрати типу м.ц.к. м.п.у., рідше о.ц.к. Тип ґрат визначається величиною відносини атомного радіуса неметалу до атомного радіуса металу. З'єднання з простими ґратами називаються фазами впровадження. Хімічна формула їх проста: Хутро, МеаХ, МеХг, Мё4Х (Ме— метал, Х—неметалл), наприклад РегМ, Ре4М, \ВУС. Фази впровадження мають велике практичне значення, забезпечуючи значне зміцнення металевих сплавів. Хімічні сполуки позначаються формулою з'єднання, наприклад АтВл.
В. Механічні суміші. При сплавці компонентів з великим розходженням атомних радіусів і значним розходженням електрохімічних властивостей їхня взаємна розчинність дуже мала й утвориться механічна суміш із кристалів вихідних компонентів (наприклад, сплави Рb-Sb, Zn-Sn, Pb-В і ін.). Тим часом варто пам'ятати, що абсолютна відсутність взаємної розчинності в реальних сплавах не зустрічається. Компоненти в сплаві позначають символами їхніх елементів.
При вивченні наступного матеріалу, особливо діаграм стану сплавів, дуже важливо, щоб студент розумів особливості будівлі цих основних фаз у сплавах. У першу чергу те, що тверді розчини можуть існувати, маючи перемінний склад, у той час як хімічні сполуки і чисті компоненти існують тільки при постійному складі.
Проміжними фазами в сплавах є упорядковані тверді розчини, електронні з'єднання, фази Ловеса й ін.
Упорядкованим називаються тверді розчини, у яких атоми компонентів А и В розташовані не хаотично, як у звичайних твердих розчинах, а упорядковано. Звичайна будівля (структура) упорядкованого твердого розчину є проміжною між фазою зі зробленим порядком (хімічні сполуки) і фазою з повним безладдям (твердий розчин). Упорядковані тверді розчини називаються також надструктурами. Склад надструктур можна виразити хімічною формулою. Так, для сплавів Au-Cu відомі надструктури Сu3Аu і СuАu зі складом 1:3 і 1:1 атомів Аu і Сu відповідно. Утворення надструктур супроводжується різкою зміною властивостей сплаву (росте міцність, знижується пластичність).
Електронні сполуки або фази Юм-Розери типові для сплавів систем СuZn, Сu-Sn, Сu-А1 і ін.
Ці сполуки відрізняються постійними співвідношеннями числа валентних електронів до числа атомів, тобто електронною концентрацією N. рівної ''/а, "Лз і 'Л, наприклад Си2п (N=3/2), Си2пз(М=7<). Си52п^= ^/.з). При N=• ^/2 сполуки мають ґратку типу о.ц.к., при М== /|з— складну у-ґрати, при N=7/^-гексагональну е-гратку. На базі електронних сполук можуть утворитися і тверді розчини.
До хімічних металевих сполук відносяться також фази Ловеса, що мають формулу типу АВд, коли відносини атомних радіусів Гд/гд^ 1,2 (частіше 1,1...1,6), наприклад М^Па (ґратки м.п.у.), М^Сиг (ґратки м.ц.к.). До цих фаз відносяться з'єднання ряду перехідних металів (Псгг, 2м^2 і ін.).
Фази зі структурою інкельарсеніду утворяться між перехідними металами і простими металами (М1Ав, Ре5п, М15Ь и ін.).
Інформаційні джерела:
1. Технологія конструкційних матеріалів./За ред. А.М. Сологуба. - К.: Вища школа, 1993 –
300 с.
2. Большаков В.І., Береза О.Ю., Харченко В.І. Прикладне матеріалознавство: Підручник. Дніпропетровськ: РВА „Дніпро VAL”.2000 – 290 с.
3. Технология конструкционних материалов. /Г.А. Прейс, М.А. Сологуб, И.А. Рожнецкий/ - К.: Вища школа 1991 – 391 с.
4. Дальский А.М. и др. Технология конструкционных материалов, М.: Машиностроение. 1990 - 351 с.
Дата добавления: 2015-03-14; просмотров: 1074;
