АНАЛИЗ ФАЗОВЫХ РАВНОВЕСИЙ В ДВОЙНЫХ СИСТЕМАХ
Сплавом называется вещество, полученное сплавлением двух или нескольких металлов или металла с неметаллом и обладающее металлическими свойствами. В настоящее время определение "сплав" имеет более широкое понятие, так как в современных условиях он может быть получен не только сплавлением, но и другими способами: прессованием-спеканием (порошковая металлургия), электролизом, возгонкой, в процессе кристаллизации из паров в вакууме и т.д. Такие сплавы ранее называли псевдосплавами (псевдо - ложный).
Сплавы образуют компоненты, взаимодействие которых определяется концентрацией (внутренний термодинамический фактор), температурой, давлением и др. (внешние термодинамические факторы). Компонентом называют химические индивиды (элементы и соединения), взятые в количествах, необходимых для образования всех фаз системы. Компонентами обычно являются чистые вещества (металлы и неметаллы), а также устойчивые, т.е. не разлагающиеся до температуры плавления на составляющие, химические соединения.
Фаза - однородная (жидкая, твердая, газообразная) часть системы, имеющая одинаковое строение, состав, свойства и отделенная от других фаз поверхностью раздела.
Системой называется совокупность фаз в твердом, жидком и газообразном состояниях, взятая для исследования при известных условиях и занимающая определенный объем.
В металловедении системами являются чистые металлы или металлические сплавы.
1.2 Фазы в металлических сплавах
Строение металлических сплавов зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав (систему).
Компоненты, взаимодействуя друг с другом, могут образовывать твердые растворы, химические соединения и гетерогенные (неоднородные) структуры, состоящие из нескольких фаз.
Твердые растворы образуются в том случае, когда компоненты сплава растворимы друг в друге в твердом состоянии. Рентгеновский анализ обнаруживает в твердом растворе, как и у чистого металла, только один тип кристаллической решетки, металлографический - выявляет структуру из однородных зерен. Если кристаллизуется твердый раствор на базе одного из компонентов, последний является растворителем, а атомы другого (растворенного) компонента располагаются в кристаллической решетке растворителя.
Твердые растворы обозначаются буквами греческого алфавита: a, b, d, g и т.д.; или А(В), где А - растворитель, В - растворенный компонент. Твердые растворы существуют не при строго определенном соотношении атомов компонентов, а в интервале концентраций.
Различают твердые растворы замещения, внедрения и вычитания.
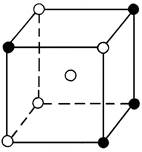
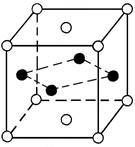
В твердых растворах замещения атомы растворенного компонента занимают положения атомов растворителя в кристаллической решетке (рис.1, а). Твердые растворы замещения характерны для сплавов большинства металлов (Fe, Cr, Мn, Ni, Mo, Cu, Zn, Sn, Al и др.) и могут быть с ограниченной (неполной) или с неограниченной (полной) растворимостью компонентов друг в друге.
| 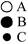
| 
|
| а | б |
Рис.1 Кристаллическая решетка твердого раствора замещения (а)
и твердого раствора внедрения (б)
Неограниченная растворимость возможна, если оба компонента имеют идентичные, изоморфные кристаллические решетки, малое различие атомных размеров компонентов в пределах 7-17%, близкое расположение компонентов в периодической системе элементов Д.И. Менделеева.
Твердые растворы внедрения получаются в тех случаях, когда диаметр растворенного элемента невелик, и наблюдаются при растворении в железе, молибдене, хроме таких неметаллов, как углерод, азот, водород, т.е. элементов с малым атомным радиусом. Твердые растворы внедрения бывают только с ограниченной (неполной) растворимостью компонентов (рис.1, б).
В сплавах могут также образоваться твердые растворы на базе химического соединения, где химическое соединение является растворителем, сохраняется его кристаллическая решетка, а атомы растворенного элемента располагаются в этой кристаллической решетке.
Твердыми растворами вычитания называются твердые растворы на базе химических соединений, образование которых сопровождается появлением вакансий. Например, таким является твердый раствор на базе химического соединения СoАl.
При образовании твердых растворов замещения и внедрения атомы растворенного элемента располагаются в кристаллической решетке растворителя неупорядоченно, в связи с этим их называют неупорядоченными твердыми растворами.
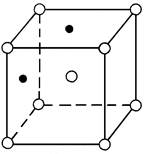
В некоторых случаях, когда атомы элементов, составляющие сплав, притягиваются друг к другу сильнее, чем подобные атомы, они стремятся расположиться в кристаллической решетке растворителя в определенном порядке. Такие твердые растворы называют упорядоченными или сверхструктурами (рис.2). Полностью упорядоченные растворы образуются, когда соотношение компонентов равно целому числу 1:1, 1:2, 1:3 и т.д. Упорядоченные твердые растворы можно рассматривать, как промежуточные фазы между твердыми растворами и химическими соединениями.
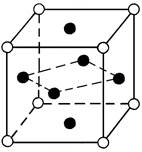
| 
| |
| Cu3Au | CuAu |
Рис.2 Кристаллические решетки упорядоченных твердых растворов
в системе Cu-Al (Cu - l; Al -¡)
Химические соединения образуются в том случае, когда атомы различных элементов притягиваются и имеют электрохимическое различие. Характерным для химических соединений является стехиометрическое соотношение атомов элементов, что выражается простой формулой в общем виде АnВm, где А и В - элементы, n и m - простые целые числа. В химических соединениях кристаллическая решетка, как правило, отличная от кристаллических решеток элементов, атомы в решетке располагаются упорядочение, закономерно в определенных узлах.
Химические соединения имеют постоянную температуру плавления (диссоциации), свойства соединения резко отличаются от свойств образующих его компонентов.
Химическое соединение между металлами имеет в узлах решетки положительно заряженные ионы, удерживаемые электронным газом - металлическая связь. Такие соединения называются интерметаллидами (CuAl2, Mg2Sn и т.д.). Химические соединения металла c неметаллом имеют ионную связь, атомы удерживаются в кристаллической решетке электростатическим притяжением. В соединениях такого типа связь жесткая.
Электронные соединения, т.е. соединения между двумя металлами в сплавах, отличается постоянным соотношением валентных электронов к числу атомов 3/2; 21/13; 7/4. Каждому соотношению соответствует определенная кристаллическая решетка: 3/2 - b-фаза (решетка объемноцентрированного куба), 21/13 - g-фаза (решетка сложная кубическая), 7/4 - d-фаза (гексагональная решетка).
Электронные соединения (фазы Юм-Розери) имеют определенное соотношение атомов и новую кристаллическую решетку - это признаки химического соединения, однако полного упорядочения расположения атомов не наблюдается, поэтому их относят к промежуточным фазам между химическим соединением и твердым раствором.
Фазы Лавеса имеет формулу АВ2 (А и В компоненты) и наблюдаются между элементами, атомные диаметры которых DA/DB=1,2. Эти фазы при кристаллизации образуют кристаллические решетки: гексагональную (MgZn2 и МgNi2) или гранецентрированную кубическую (MgCu2). Фазы Лавеса встречаются в сплавах, как упрочняющие фазы.
Гетерогенные (неоднородные) структуры образуются в том случае, когда ко-мпоненты не обладают полной взаимной растворимостью друг в друге в твердом стоянии, например: Zn-Sn; Pb-Sn; Fe-C; Al-Cu и др. Число кристаллических решеток соответствует числу фаз, образующихся в гетерогенной структуре.
Если компоненты незначительно растворяются друг в друге в твердом состоянии (Ge-Zn), то фактически получается микросмесь, состоящая из двух чистых компонентов.
При количестве компонентов, превышающих их предельную растворимость, наблюдается структура из двух насыщенных твердых растворов или твердого раствора и химического соединения и т.д. Такая структура может быть эвтектического или перитектического типа.
АНАЛИЗ ДИАГРАММ СОСТОЯНИЯ ДВОЙНЫХ СИСТЕМ
Диаграммой состояния называется графическое изображение фазового состояния сплава в зависимости от внешних (температуры, давления и др.) и внутренних (концентраций компонентов) факторов.
Диаграммы состояния двойных и более сложных систем строят экспериментальными методами для условий равновесия, при которых состояние сплавов соответствует минимальному значению свободной энергии. Такое состояние сплавов может быть достигнуто только при бесконечно медленных скоростях охлаждения или нагрева, поэтому диаграммы состояния позволяют определить фазовые превращения при очень медленном охлаждении или нагреве. Закономерность существования устойчивых фаз, отвечающих термодинамическими условиями равновесия, может быть выражена в математической форме правилом фаз или законом Гиббса (1876 г.). Оно устанавливает связь между числом компонентов - К, числом равновесных фаз - Ф, внешними факторами (температурой, давлением и др.) - В, вариантностью (или числом степеней свободы) равновесной системы - С. В общем виде математически выражается уравнением:
| С = К + В - Ф | |
| при В = 2 (t, P) | С = К + 2 - Ф |
| при В = 1 (t) | С = К + 1 - Ф |
Под числом степеней свободы подразумевается число внешних (температура, давление и др.) и внутренних (концентрация) факторов равновесной системы, которое можно изменять в определенных пределах без изменения числа фаз, находящихся в равновесии. Более строгим является использование термина "число независимых переменных".
Вариантность (или число степеней свободы) любой системы всегда положительна или равна нулю, т.е. С³0. При С=0 система называется нонвариантной. Это значит, что все независимые переменные, определяющие состояние системы, имеют строго определенные (единственные) значения и их нельзя изменить, чтобы не нарушить фазового равновесия, при этом в равновесии находятся три фазы. При С=1 систему называют моновариантной, т.е., если изменить внешний фактор - температуру, изменится концентрация фаз, но равновесие не нарушится. В равновесии находятся две фазы - жидкая и твердая или две твердые. При С=2 система называется бивариантной, т.е. существует область на диаграмме, в которой можно изменить температуру и концентрацию сплава, не нарушая равновесия. В равновесии находится одна фаза.
Правило фаз позволяет определить максимально возможное число равновесных фаз в сплавах, установить отклонение (по числу фаз) в структуре сплавов от равновесных условий, дает возможность контролировать правильность построения диаграмм состояний и кривых охлаждения (нагрева).
2.1. Диаграмма состояния для сплавов с неограниченной растворимостью компонентов в твердом состоянии.
Компоненты этих сплавов неограниченно растворимы в жидком и твердом состояниях, не образуют химических соединений. В данном случае при затвердевании образуются однородные по структуре сплавы, состоящие из зерен - твердого раствора компонента В в А (или А в В). По этому типу диаграммы кристаллизуются сплавы Sb-Bi, Cu-Ni, Au-Ag, Fe-Ni и некоторые другие. Общий вид типовой диаграммы показан на рис.3.
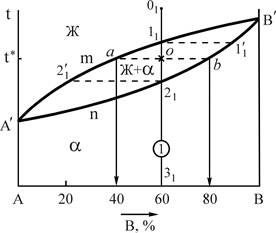
Рис.3. Диаграмма состояния системы А-В, с неограниченной
растворимостью в твердом состоянии
Компоненты: А и В (К=2); фазы: Ж, a (твердый раствор) (Ф=2); линия А'nB' - линия солидус - геометрическое место точек критических температур конца процесса кристаллизации всех сплавов данной системы при охлаждении и начала плавления при нагреве; линия А'mB' - линия ликвидус, геометрическое место точек критических температур начала процесса кристаллизации всех сплавов данной системы при охлаждении и конца плавления при нагреве.
По диаграмме этого типа кристаллизация всех сплавов протекает аналогично сплаву 1.
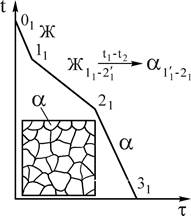 Рис.4. Кривая охлаждения и схема структуры сплава 1 при нормальной температуре
Рис.4. Кривая охлаждения и схема структуры сплава 1 при нормальной температуре
| При кристаллизации сплава 1 (рис.4) от температуры 01 в нем происходят следующие превращения. До температуры точки 11, жидкий сплав охлаждается. При температуре точки 11, начинается процесс кристаллизации (зарождение центров кристаллизации). В интервале температур 11-21 кристаллизуется из жидкого сплава a-твердый раствор, состав которого изменяется по линии солидус на участке 1¢1-21, состав жидкой фазы изменяется по линии 11-2¢1 (см.рис.4). В соответствии с диаграммой состояния во всем интервале температур 11-21 образуются кристаллы a- твердого раствора, |
более богатые тугоплавким элементом В, чем исходный сплав 1. Это приводит к неоднородности химического состава в пределах одного зерна (дендрита), так называемой дендритной ликвации, которая при реальных условиях охлаждения сохраняется в твердых растворах.
Однако при очень медленном (равновесном) охлаждении состав сплава успевает выровняться за счет диффузии и структура твердого раствора получается однородной (см. рис.4).
В двухфазных областях и на линиях нонвариантных равновесий диаграмм двойных систем с помощью правила отрезков можно определить состав (концентрацию компонентов в фазах) и количественное соотношение фаз.
Для того, чтобы определить концентрацию компонентов в фазах (их состав), через заданную точку, характеризующую состояние сплава, проводят горизонталь (коноду) до пересечения с линиями, ограничивающими данную область; проекции точек пересечения на ось концентраций показывают составы фаз.
Определим составы фаз для сплава 1 при температуре t* (см. рис.3). Для этого, проводя при температуре t* горизонталь до пересечения с линиями, ограничивающими область А¢В¢А¢, получим точки пересечения "a" и "b". Проекция точки "а" на ось концентрации определяет состав жидкой фазы - 40%В и 60%А. Проекция точки "b" показывает состав твердой фазы - 80%В и 20%А.
Для того чтобы определить количественное соотношение фаз по правилу отрезков, необходимо через заданную точку провести горизонталь до пересечения с ближайшими линиями диаграммы состояния. Отрезки этой линии между заданной точкой и точками пересечения, определяющими составы фаз, обратно пропорциональны количествам этих фаз.
Например, относительное весовое количество твердой фазы для сплава 1 (см. рис.3) при температуре t*:
ОВКa = 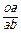 =
= 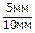 = 0,5 или 50 %.
= 0,5 или 50 %.
Относительное весовое количество жидкой фазы при температуре t*:
ОВКЖ = 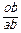 =
= 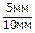 = 0,5 или 50 %.
= 0,5 или 50 %.
2.2. Диаграмма состояния сплавов с ограниченной взаимной растворимостью компонентов в твердом состоянии
В таких сплавах компоненты неограниченно растворимы в жидком состоянии, ограниченно в твердом и не образуют химических соединений.
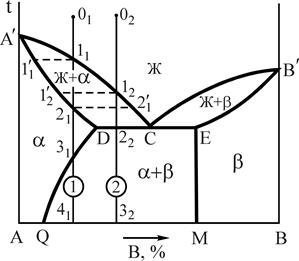
Рис.5 Диаграмма состояния системы А-B с эвтектическим превращением
Существуют два вида таких диаграмм: с эвтектическим и перитектическим превращением. Для сплавов Al-Si, Al-Cu и других характерна диаграмма с эвтектическим превращением, в результате которого по реакции 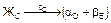 образуется микросмесь двух фаз (эвтектика). Эвтектика в переводе с греческого - легкоплавкий. Общий вид типовой диаграммы показан на рис.5.
образуется микросмесь двух фаз (эвтектика). Эвтектика в переводе с греческого - легкоплавкий. Общий вид типовой диаграммы показан на рис.5.
Компоненты: А и В (К=2); фазы: Ж, a-твердый раствор, b-твердый раствор (Ф=3). Название a- и b-твердых растворов принимается условно, т.е. a-твердым раствором называем раствор компонента В в А , а b-твердый раствор - раствор компонента А в В. Линия А'СВ' - линия ликвидус, линия А'DЕВ' - линия солидус, линия DQ- линия предельной растворимости компонента B в А, линия ЕМ- предельной растворимости А в В, линия DСЕ - линия эвтектического превращения.
Рассмотрим кристаллизацию двух сплавов 1 и 2. При охлаждении от точки 01 до температуры точки 11 происходит охлаждение жидкого сплава 1. При температуре точки 11 - образование центров кристаллизации в жидкой фазе. В интервале температур 11-21 - рост кристаллов a-твердого раствора из этих центров, при этом состав жидкой фазы изменяется по линии ликвидус, а твердой - по линии солидус. При температуре точки 21 заканчивается процесс кристаллизации a-твердого раствора, состав зерен соответствует исходному сплаву 1, т.к. в условиях равновесия, т.е. при очень медленном охлаждении, происходит выравнивание состава зерен за счет диффузии.
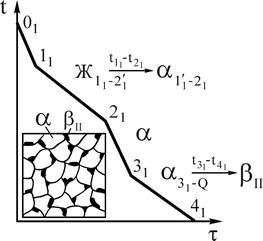
Рис.6 Кривая охлаждения и схема структуры сплава 1
при нормальной температуре
В интервале температур 21-31 - охлаждение a-твердого раствора. Температура точки 31 соответствует предельной насыщаемости a-
твердого раствора компонентом В, с понижением температуры растворимость компонента В в А снижается. Предельная растворимость в интервале температур 31-41 соответствует по диаграмме (см. рис.5) линии 31-Q, поэтому от температуры точки 31 начинается процесс вторичной кристаллизации. Из a-твердого раствора выделяется избыточный компонент В в виде b-твердого раствора, который обозначаем bII, в отличие от b, выделившегося при первичной кристаллизации. Выделение фазы bII может происходить как по границам, так и внутри зерен a-твердого раствора. В точке 41 состав a-твердого раствора соответствует точке Q, а bII-точке М (см. рис.5). Кривая охлаждения приведена на рис.6.
Кристаллизация доэвтектического сплава 2 начинается при температуре точки 12. В процессе кристаллизации в интервале температур 12-22 состав a-твердого раствора изменяется по линии 1¢2-D, а жидкой фазы - 12-С (см. рис.5). При температуре точки 22 жидкая фаза имеет состав точки С и затвердевает в эвтектику (участок 22-2¢2 кривой охлаждения), состоящую из a-твердого раствора состава точки D и b-твердого раствора, состава точки Е (по правилу отрезков). Охлаждение от точки 22 до точки 32 сопровождается выделением из a-твердого раствора, как структурно свободного, так и входящего в состав эвтектики b-твердого раствора (bII). Объясняется это тем, что состав a-твердого раствора уменьшается по компоненту В соответственно линии (см. рис.5) DQ. Кривая охлаждения сплава 2 приведена на рис.7.
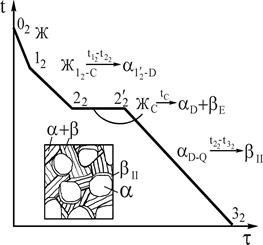
Рис.7. Кривая охлаждения и схема структуры сплава 2
при нормальной температуре
В предыдущей диаграмме (см. рис.5) мы рассмотрели превращение, при котором жидкая фаза определенного состава кристаллизовалась в две фазы, т.е. эвтектическое превращение. Возможен и другой тип трехфазного равновесия - перитектическое превращение (рис.8).
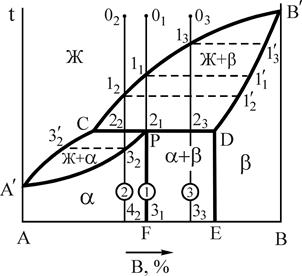
Рис.8. Диаграмма состояния системы А-В с перитектическим превращением
Перитектическим превращением называется превращение, при котором жидкая фаза, реагируя с ранее выделившейся твердой фазой, образует новую твердую фазу.
Перитектическая реакция протекает при строго определенных составах фаз, их количествах и постоянной температуре. Это превращение имеет место при кристаллизации сплавов: Cu-Zn; Cu-Sn; Cu-Al и др. Общий вид диаграммы состояния показан на рис.8.
В данной системе компоненты: А и В (К=2), фазы: Ж, a, b (Ф=3); a-ограниченный твердый раствор компонента В в A, b-ограниченный твердый раствор компонента А в В. Линии А'СВ' - ликвидус, А'PDВ' - линии солидус, линия СРD - линия перитектического превращения, линия PF линия предельной растворимости компонента B в А, линия DЕ - предельной растворимости А в B.
Рассмотрим кристаллизацию трех сплавов 1, 2 и 3.
До температуры точки 11 - охлаждение жидкого сплава 1. Начало кристаллизации сплава соответствует температуре точки 11, из жидкого
сплава начинают кристаллизоваться кристаллы b-твердого раствора. При кристаллизации в интервале температур 11-21 состав жидкой фазы изменяется по линии ликвидус на участке 11-С, а кристаллов b-твердого раствора по линии солидус на участке 1¢1-D. При температуре точки 21, в равновесии находятся жидкая фаза состава точки С и b-кристаллы состава точки D, происходит перитектическое превращение по реакции 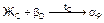 .
.

Рис.9 Кривая охлаждения и схема структуры сплава 1
при нормальной температуре
Соотношение количества жидкой фазы и кристаллов b-твердого раствора, необходимое для образования a-твердого раствора состава точки Р, с помощью правила отрезков равно 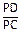 , т.е. для образования a-твердого раствора указанного состава полностью расходуется жидкая фаза и кристаллы b-твердого раствора. После перитектического превращения происходит охлаждение a-твердого раствора (участок 2¢1-31 кривой охлаждения, рис.9).
, т.е. для образования a-твердого раствора указанного состава полностью расходуется жидкая фаза и кристаллы b-твердого раствора. После перитектического превращения происходит охлаждение a-твердого раствора (участок 2¢1-31 кривой охлаждения, рис.9).
Кристаллизация сплава 2 до температуры точки 22 протекает аналогично сплаву 1 (см. рис.8 и 9).
Особо подчеркнем, что в сплавах левее точки Р перитектическое превращение происходит с избытком жидкой фазы. При температуре точки 2 произойдет перитектическое превращение по реакции 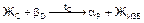
Соотношение количества жидкой фазы и кристаллов b-твердого раствора равно  .
.
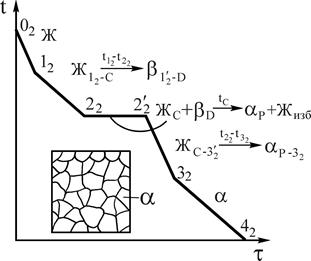
Рис.10 Кривая охлаждения и схема структуры сплава 2
при нормальной температуре
Отрезок 22D больше отрезка РD, поэтому часть жидкой фазы после перитектического превращения остается неизрасходованной. При дальнейшем охлаждении в интервале температур 22-32 происходит кристаллизация избыточной жидкой фазы, из которой выделяются кристаллы a-твердого раствора. В интервале температур 32-42 - охлаждение сплава, имеющего однородные зерна a-твердого раствора. Кривая охлаждения сплава 2 приведена на рис.10.
В отличие от сплава 2 в сплаве 3 перитектическое превращение протекает с избытком твердой фазы по реакции 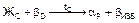 .
.
Соотношение количества жидкой фазы и b-твердого раствора в перитектическом превращении равно 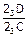 . Отрезок 23С больше отрезка PC, поэтому по окончании реакции в избытке остаются кристаллы b-твердого раствора.
. Отрезок 23С больше отрезка PC, поэтому по окончании реакции в избытке остаются кристаллы b-твердого раствора.

Рис.11 Кривая охлаждения и схема структуры сплава 3
при нормальной температуре
Структура этого сплава состоит из зерен a-твердого и b-твердого растворов. Характерным для данной структуры является расположение зерен избыточной фазы b внутри зерен a-твердого раствора, т.е. зерна b как бы окружены зернами a-фазы. Отсюда и название перитектического превращения (перитектика в переводе с греческого - окружение). Кривая охлаждения сплава 3 приведена на рис.11.
2.3 Диаграмма состояния сплавов с устойчивым химическим соединением
Устойчивым химическим соединением называется соединение, которое не диссоциирует на составные части до температуры плавления, т.е. при их плавлении составы жидкой и твердой фаз совпадают. Такие соединения называются конгруэнтно (соответственно) плавящимися и образуются в системах Mg-Si, Mg-Pb, W-Zr и др. Если химическое соединение АnВm образуется металлами, такое соединение стехиометрического состава принято называть интерметаллидной фазой.
На рис.12 представлены 2 варианта диаграмм с устойчивым химическим соединением, каждая из которых состоит из двух частей, разделенных фигуративной линией химического соединения. Компоненты: А и В (К=2); фазы: Ж, a, b, g (Ф=4). АnВm - химическое соединение, которое образуется при концентрации, соответствующей проекции точки С на ось концентраций, точка С соответствует температуре плавления, g - твердый раствор на базе химического соединения АnВm. Линия А¢ECРВ¢ - линия ликвидус, A¢DQCGРFB¢ - линия солидус.

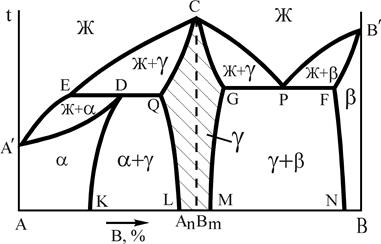
Рис.12 Диаграммы состояния системы А-В
с устойчивым химическим соединением
Физически, выполняя функцию компонента, химическое соединение на базе своей решетки, как правило, образует по схеме замещения ограниченный твердый раствор g. Плавление (кристаллизация) g-фазы состава АnВm в соответствии с правилом фаз (С=0) происходит при постоянной температуре. Прочтение диаграмм и анализ фазового состояния системы А-В производится по частям, имея ввиду независимость систем А-АnВm и АnВm-В. Особенностью диаграмм с устойчивым химическим соединением является область g-фазы. В этой области левее фигуративной линии химического соединения (заштрихована) представлены твердые растворы замещения компонента А, а правее фигуративной линии – растворы компонента В в химическом соединении. При образовании твердых растворов атомы компонента А замещают атомы компонента В в узлах кристаллической решетки соединения АnВm или наоборот. Таким образом формируется область g-раствора переменной концентрации с решеткой, свойственной химическому соединению. В силу этих особенностей g-фаза называется промежуточной.
Кристаллизацию характерных сплавов для таких диаграмм рассматривали ранее.
2.4. Диаграмма состояния для сплавов с неустойчивым химическим соединением
Неустойчивыми называются химические соединения, при плавлении которых образуется жидкая и кристаллическая фазы, отличающиеся по составу от химического соединения. При этом во взаимодействии в форме перитектического равновесия находятся три фазы определенного состава (рис.13). Такие фазы – химические соединения называются инконгруэнтно (несоответственно) плавящимися.
При охлаждении жидкости, соответствующей по составу соединению АnВm, в интервале температур 11-G реализуется первая стадия кристаллизации в форме реакции 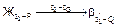 (С=1), а на уровне температуры точки G завершается кристаллизация в форме нонвариантного перитектического превращения
(С=1), а на уровне температуры точки G завершается кристаллизация в форме нонвариантного перитектического превращения 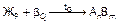 (С=0).
(С=0).
Очевидно, что химическое соединение сохраняет свою кристаллическую структуру и состав и при более низких температурах.
Другие сплавы в интервале концентраций P-Q также претерпевают перитектическое превращение, однако после своего завершения в сплавах интервала P-G в соответствии с правилом отрезков в избытке остается жидкость ЖИЗБ, а в сплавах интервала G-Q в остатке оказывается твердый раствор bИЗБ.
Промежуточная g-фаза переменного состава, формирующаяся на базе кристаллической решетки химического соединения представлена на диаграмме заштрихованной областью.
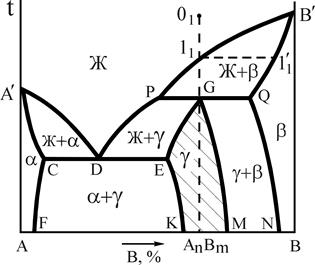
Рис.13. Диаграмма состояния системы А-В с неустойчивым химическим соединением
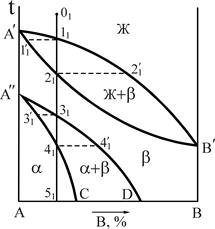
2.5. Диаграммы состояния сплавов, компоненты которых имеют полиморфные превращения
Полиморфизмом отличаются многие металлы – железо, марганец, титан, олово и др. Благодаря полиморфизму компонентов сплавы в кристаллическом состоянии претерпевают превращения, которые приводят к существенному изменению структуры и свойств.
На рис.14,а показан вариант диаграммы состояния сплавов, в которых компонент А существует в двух полиморфных модификациях - a и b. При взаимодействии этих модификаций с компонентом В образуются соответствующие фазы – твердые растворы, сохраняющие при определенных концентрациях и температурах тип кристаллической решетки одного из компонентов.
В сплавах в интервале концентрации C-D фазовая перекристаллизация протекает частично и поэтому в конечной структуре сосуществуют a- и b-фазы в количествах, зависящих от состава сплава.
| 
|
| а | б |
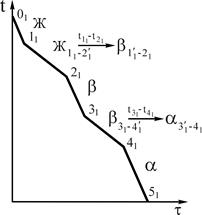
Рис.14 Диаграмма состояния (а), кривая охлаждения и фазовые реакции (б) сплава 1 системы с полиморфизмом компонента А
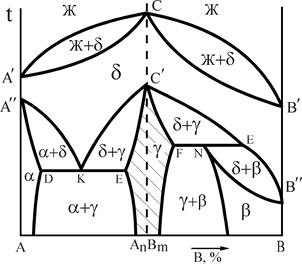
Рис.15 Диаграмма состояния системы А-В
с полиморфными превращениями обоих компонентов
На рис.15 представлен один из возможных вариантов диаграммы состояния сплава, оба компонента которого отличаются полиморфизмом. В рассмотренном случае продукт первичной кристаллизации - d-раствор претерпевает фазовую перекристаллизацию с образованием a-, b- и g-растворов.
Сплавы в интервале концентраций D-E проходят фазовую перекристаллизацию подобно эвтектическому превращению по реакции 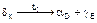 . Такое нонвариантное превращение называется эвтектоидным.
. Такое нонвариантное превращение называется эвтектоидным.
Полученная смесь фаз называется эвтектоидом. В сплавах в интервале концентраций F-Е происходит перекристаллизация в виде нонвариантного перитектоидного превращения 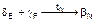 .
.
Дата добавления: 2015-03-14; просмотров: 3246;
