ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ИБС
Лекарственное лечение при хронической ИБС в основном осуществляется двумя путями: 1) усилением кровотока в коронарных артериях для улучшения перфузии ишемизированного миокарда; 2) уменьшением потребности в кислороде ишемизированным миокардом. Нитраты являются сильными коронарными вазодилятаторами, сосудорасширяющее действие оказывается преимущественно на венозное русло. Снижение венозного возврата крови способствует снижению потребности миокарда в кислороде. Бета-адреноблокаторы уменьшают частоту и силу сердечных сокращений, что также способствует снижению метаболизма в миокарде. Антагонисты кальция являются мощными коронарными вазодилататорами и преимущественно эффективны при спазме коронарных артерий. Кроме того, вышеперечисленные группы препаратов снижают артериальное давление, тем самым, уменьшая постнагрузку. Внедрение в практику лечения ИБС лекарственных препаратов, блокирующих бетта-адренергические рецепторы, пролонгированных нитратов и антагонистов кальция, значительно улучшило результаты лечения. Тем не менее, существует большая группа пациентов нуждающихся в хирургическом лечении. Развитию прямых реваскуляризирующих операций способствовало внедрение коронарографии. Метод селективной коронарографии был впервые применен в Кливлендской клинике (США) кардиологом Ф. Соунес в 1959 году. В основном сейчас для выполнения коронарографии используется доступ через бедренную артерию по Сельдингеру. Специальный катетер проводится в устье коронарной артерии. За счет боковых отверстий катетер не обтурирует коронарные артерии и не прекращает кровоток в них во время исследования. Затем вводится рентгеноконтрастное вещество, и поочередно визуализируются системы левой и правой коронарных артерий. Исследования проводятся на специальных ангиографических установках (фирма "Сименс" и другие). Во время этой процедуры определяется также ряд различных параметров, свидетельствующих о состоянии сердечной деятельности (фракция выброса, сердечный индекс, сократимость миокарда, конечно – диастолическое давление в левом желудочке и другие), а также проводится левая вентрикулография. Во время последней можно диагностировать наличие аневризмы левого желудочка или участков тромбоза.
Впервые об успешной операции АКШ сообщил Рене Фавалоро в 1967 году (г. Кливленд, США). В 1964 году H.Garret, M.De Bakey выполнили аортокоронарный шунт с использованием большой подкожной вены. Тем не менее, они опубликовали свои результаты лишь в 1973 году. В настоящее время эта операция нашла самое широкое применение в развитых странах. Время показало, что после оперативного лечения значительно удлиняется жизнь больных с ИБС. Для реваскуляризации миокарда использовались сегменты бедренной, правой желудочно-сальниковой и наружночревной артерий. Однако наиболее распространенным трансплантатом стала большая подкожная вена. Также используется фрагмент лучевой артерии. Выполняется множественное шунтирование с включением в кровоток нескольких коронарных артерий. Иногда проводится коронарная эндартерэктомия у больных с диффузным поражением дистального коронарного сосудистого русла. Недостатками аутовенозных шунтов является их постепенное закрытие в связи с возникающими морфологическими изменениями: гиперплазия интимы, аневризматическое расширение стенки, атероматоз. В среднем сроки функционирования аутовенозных шунтов составляют от 7 до 10 лет. К 10 годам функционирует менее 50% шунтов. В 1964 году в Ленинграде выдающийся русский хирург Василий Иванович Колесов впервые в мире успешно осуществил прямую реваскуляризацию миокарда с помощью внутренней грудной (маммарной) артерии. Сейчас во всем мире широко используется эта методика. Подчеркиваем, что В.И. Колесов проводил операции маммарно-коронарного анастомоза без аппарата искусственного кровообращения на работающем сердце, доступ к которому осуществлялся путем левосторонней торакотомии. Установлено, что используемая для коронарного шунтирования внутренняя грудная артерия более чем в 90% случаев не облитерируется в течение 15 лет. Поэтому в настоящее время в основном для восстановления кровотока в передней межжелудочковой артерии используется внутренняя грудная артерия. Имеются сообщения об использование для АКШ биотрансплантатов (Zurbrugg H.R, 1998).
Операция АКШ проводится с применением экстракорпорального искусственного кровообращения и кардиоплегии на выключенном ("сухом") сердце. Доступом к сердцу является продольная полная срединная стернотомия. Затем канюлируются восходящая аорта, полые вены (или консолью правое предсердие), и подключается аппарат искусственного кровообращения (АИК). Одновременно с нижних конечностей оперируемого берутся основные стволы подкожных вен. Затем пережимается восходящая часть аорты и проводится кардиоплегическая остановка сердца. Накладываются дистальные анастомозы аутовен с коронарными артериями. Количество накладываемых шунтов (2-9, в среднем - 4) зависит от состояния коронарного русла. Для выполнения маммарно-коронарного анастомоза левая внутренняя грудная артерия выделяется совместно с окружающими тканями и венами в виде сосудистого-мышечного лоскута (in situ) или путем скелетизации. Она мобилизуется с помощью коагулятора, а ее мелкие боковые веточки клиппируются или прижигаются электрокоагулятором. Правая внутренняя грудная артерия преимущественно выделяется путем скелетизации. Перед окончанием окклюзии, тщательно проводятся мероприятия, профилактирующие возникновение воздушной эмболии. Затем снимается зажим с аорты. На фоне продолжающейся профилактики воздушной эмболии с помощью дефибрилятора восстанавливается сердечная деятельность. Далее накладываются проксимальные анастомозы с восходящей аортой и отключается АИК. После деканюляции производится послойное ушивание раны с оставлением дренажей в полости перикарда.
 Рис. 42. Аортокоронарное шунтирование Доступ к сердцу (продольная стернотомия) и подключение сердца к аппарату искусственного кровообращения. Рис. 42. Аортокоронарное шунтирование Доступ к сердцу (продольная стернотомия) и подключение сердца к аппарату искусственного кровообращения.
|
 Рис. 43. Аортокоронарное шунтирование Взятие и подготовка аутовены для АКШ Участок большой подкожной вены берется с медиальной поверхности бедра или голени. Все притоки лигируются на расстоянии 1 мм от места впадения в аутовены, выявленные дефекты стенки аутовены тщательно ушиваются атравматическим шовным материалом. Концы аутовены косо срезаются с дополнительным продольным рассечением. Проксимаьный конец вены, предназначенный для дистального анастомоза, необходимо маркировать. Рис. 43. Аортокоронарное шунтирование Взятие и подготовка аутовены для АКШ Участок большой подкожной вены берется с медиальной поверхности бедра или голени. Все притоки лигируются на расстоянии 1 мм от места впадения в аутовены, выявленные дефекты стенки аутовены тщательно ушиваются атравматическим шовным материалом. Концы аутовены косо срезаются с дополнительным продольным рассечением. Проксимаьный конец вены, предназначенный для дистального анастомоза, необходимо маркировать.
| ||
Рис. 44. Аортокоронарное шунтирование
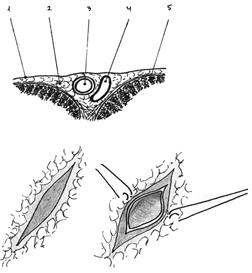 А. Поперечный срез стенки сердца в месте прохождения венечной артерии 1.Эпикард 2.Субэпикардиальная жировая ткань 3.Вененчная артерия 4.Вена сердца 5.Миокард
Б. Подготовка венечной артерии для наложения дистального анастомоза с шунтом: - обнажение стенки венечной артерии рассечением эпикарда; - вскрытие просвета венечной артерии на протяжении 6-10 мм
А. Поперечный срез стенки сердца в месте прохождения венечной артерии 1.Эпикард 2.Субэпикардиальная жировая ткань 3.Вененчная артерия 4.Вена сердца 5.Миокард
Б. Подготовка венечной артерии для наложения дистального анастомоза с шунтом: - обнажение стенки венечной артерии рассечением эпикарда; - вскрытие просвета венечной артерии на протяжении 6-10 мм
| Рис. 45. Аортокоронарное шунтирование
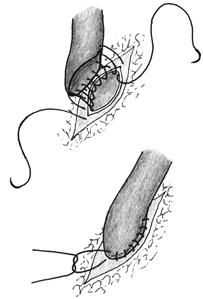 Создание дистального анастомоза шунта с венечной артерией. Проксимальный конец аутовены вшивается в разрез венечной артерии (конец в бок) непрерывным обвивным швом или отдельными узловыми швами
Создание дистального анастомоза шунта с венечной артерией. Проксимальный конец аутовены вшивается в разрез венечной артерии (конец в бок) непрерывным обвивным швом или отдельными узловыми швами
| ||
Рис. 46. Аортокоронарное шунтирование

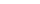 Создание проксимального анастомоза шунта с восходящей аортой
Создание проксимального анастомоза шунта с восходящей аортой
- аорта
- коронарная артерия
-
 аутовена
аутовена
 Рис. 47. Аортокоронарное шунтирование Различные варианты шунтирования в зависимости от локализации поражения в венечных артериях.
Рис. 47. Аортокоронарное шунтирование Различные варианты шунтирования в зависимости от локализации поражения в венечных артериях.
А.Одиночный аутовенозный шунт между восходящей аортой и правой венечной артерией Б.Одиночный аутовенозный шунт между восходящей аортой и левой венечной артерией (варианты А и Б могут быть применены одновременно) В. Y –образный или ветвистый (branched graft) аутовенозный шунт
 Рис. 48. Аортокоронарное шунтирование Различные варианты шунтирования в зависимости от локализации поражения в венечных артериях.
Рис. 48. Аортокоронарное шунтирование Различные варианты шунтирования в зависимости от локализации поражения в венечных артериях.
Г. «Подковообразный» аутовенозный шунт с одним аортальным анастомозом и двумя коленами, идущими к двум вененчым аретриям (наложение такого шунта возможно лишь при отсутствии клапанов в одном из колен аутовены). Д. «Прыгающий» аутовенозный шунт (jumped graft) – используется при двухуровневом поражении одной венечной артерии (первый уровень поражения обходится анастомозом «бок в бок» между артерией и веной, второй – анастомоз «конец в бок») Е. «Змеевидный», «мостовидный» или секвенциальный, аутовенозный шунт (snake graft, bridg graft) – последовательные анастомозы с 3-4 венечными артериями на передней и задней поверхностях сердца.
 Рис. 49. «Стандартная» операция по реваскуляризации миокарда
Рис. 49. «Стандартная» операция по реваскуляризации миокарда
Левая внутренняя грудная артерия анастомозирована с ПМЖВ.
Трансплантатами из подкожной вены шунтированы диагональная ветвь и правая коронарная артерия.
Применение искусственного кровообращения (ИК) и методов защиты миокарда обеспечило хорошие результаты лечения ИБС, которые превосходят терапевтические. Тем не менее, при операциях в условиях искусственного кровообращения возможны серьезные осложнения: микроэмболия с неврологическими последствиями, кровотечения, угнетение иммунной системы и др. Современная эпоха внесла серьезные перемены в лечение ИБС. Хирурги стали выполнять коронарное шунтирование на бьющемся сердце, что позволило исключить многие осложнения, связанные с ИК и способствует более быстрому выздоровлению пациентов. Для этого разработаны и широко применяются новые технологии интраоперационной стабилизации сердца (рис. 50.

 Рис. 50. Внешний вид системы стабилизации миокарда Octopus 2.
Рис. 50. Внешний вид системы стабилизации миокарда Octopus 2.

Ключевым моментом для наложения адекватного анастомоза с коронарной артерией на бьющемся сердце является стабилизация участка миокарда. Используется вакуумная технология присасывания, которая обеспечивает надежный контакт стабилизатора с эпикардом. Головка стабилизатора приподнимает участок миокарда и, раздвигая лапки, обнажает артерию, обеспечивая хорошую иммобилизацию участка сердца (рис.. 51).
В последние годы появляется все больше сообщений о миниинвазивных методах реваскуляризации миокарда (МИРМ) на работающем сердце. При этом реваскуляризация осуществляется из мини-доступа. МИРМ является вмешательством для хирургической реваскуляризации коронарных артерий, направленное на снижение операционной травмы и быстрое выздоровление больного, позволяющее  достичь быстрого возвращения больного к обычной жизни с меньшими расходами по сравнению со стандартным АКШ.
достичь быстрого возвращения больного к обычной жизни с меньшими расходами по сравнению со стандартным АКШ.
Рис. 51. Стабилизатор тканей Octopus 2 иммобилизирует участок миокарда приподнимая эпикард и раздвигает ткани, обнажая артерию.
Такое определение МИРМ дано Обществом грудных хирургов и Комитетом по новым технологиям Американской ассоциацией грудных хирургов (STS/AATS New Tehnology Committee, 1998/58). В России в 2003 г. количество операций коронарного шунтирования на работающем сердце выросло на 21,4%. (Л.А. Бокерия, Р.Г. Гудкова, 2003).. В 1994 году F.J. Beneti впервые опубликовал данные о видеоэндохирургической мобилизации левой внутренней грудной артерии для МИРМ. Развитие миниинвазивных методов хирургии с эндоскопическими приборами трехмерной визуализации открывает большие перспективы развития коронарной хирургии.
В настоящее время широкое распространение получили рентгеноваскулярные (интервенционные) методики лечения ИБС – ангиопластика и стентирование. Метод чрескожной транслюминальной баллонной дилатации (ангиопластики) коронарных артерий впервые применил в сентябре 1977 года швейцарский кардиолог Андреас Грюнтциг. В 1978 году в журнале «Lancet» он сообщил о 3 удачных случаях баллонной ангиопластики у пациентов с гемодинамически значимыми поражениями основного ствола левой коронарной артерии. Для проведения коронароангиопластики используются два катетера: катетер-проводник и двухпросветный дилатационный катетер. Следует отметить, что создание двухпросветного баллонного катетера стало универсальным инструментом устранения стенозов не только коронарных сосудов, но и других артерий в различных анатомических областях.
После проведения коронарографии, ангиографический катетер заменяется катетером-проводником и по нему в стенозированный участок проводится дилатационный двухпросветный катетер, имеющий на конце баллончик из поливинилхлорида в форме цилиндра. Баллончик может наполняться и опорожняться через один из просветов в катетере. Затем под давлением 5 – 10 атмосфер баллончик раздувается и находится в таком состоянии 60 – 120 секунд. В результате этого происходит равномерное давление на стенки артерии, сдавливание бляшки и необратимое перерастяжение среднего слоя сосудистой стенки. Повреждение эластических мембран предотвращает обратное эластическое спадение стенки артерии, сохраняя тем самым ее внутренний просвет. Далее баллончик опорожняется и измеряется перфузионное давление ниже стеноза.
По показаниям процедуру повторяют несколько раз. Уменьшение градиента давления и положительный коронарографический контроль определяют результат ангиопластики. Широкое внедрение в клиническую практику чрескожной транслюминальной коронарной баллонной ангиопластики стало одним из выдающихся достижений медицины XX-го века. Тем не менее, было установлено, что от 20 до 45% людей, перенесших коронарную ангиопластику в отдаленном периоде нуждаются в повторной реваскуляризации миокарда. К тому же при проведении коронарной ангиопластики возможны осложнения, наиболее тяжелыми из которых являются выраженная диссекция (отслойка) с образованием лоскута интимы или заворота бляшки, а также острая окклюзия артерии.
В 1964 году C.T. Dotter и M.R. Judkins была создана концепция об имплантации внутрисосудистых эндопротезов (стентов) для длительной поддержки сосудистой стенки. Впервые U. Sigwart и соавт. в 1986 году осуществили имплантацию самораскрывающегося стента “Wallstent” в коронарную артерию. Для улучшения отдаленных результатов и предотвращения осложнений ангиопластики в 1986 году Puel впервые стал использовать металлический эндопротез-стент. Благодаря этим исследователям была начата эра стентирования в лечении ИБС. В дальнейшем наиболее часто имплантировали стенты “Palmaz-Schatz”. В настоящее время существует более 40 моделей различных типов стентов (рис. 52, 53).
 Рис. 52. Внешний вид коронарного стента, установленного на баллонном катетере.
Рис. 52. Внешний вид коронарного стента, установленного на баллонном катетере.
 Вначале стенты устанавливали после транслюминальной баллонной ангиопластики в случаях угрожающей окклюзии коронарной артерии. После баллоной ангиопластики стент устанавливается внутри сосуда и, прижимая отслоенные фрагменты бляшки и интимы к стенке артерии, тем самым армирует ее просвет (рис. 54). Результаты исследований показали, что после установки стента нет турбулентности крови и отмечается значительное увеличение линейной, а также объемной скорости кровотока.
Вначале стенты устанавливали после транслюминальной баллонной ангиопластики в случаях угрожающей окклюзии коронарной артерии. После баллоной ангиопластики стент устанавливается внутри сосуда и, прижимая отслоенные фрагменты бляшки и интимы к стенке артерии, тем самым армирует ее просвет (рис. 54). Результаты исследований показали, что после установки стента нет турбулентности крови и отмечается значительное увеличение линейной, а также объемной скорости кровотока.

 Рис. 53. Внешний вид стента в раскрытом состоянии после проведения коронарной ангиопластики.
Рис. 53. Внешний вид стента в раскрытом состоянии после проведения коронарной ангиопластики.
Тем самым в значительной степени предотвращается возникновение тромба на поверхности дилатированной бляшки. В дальнейшем стали выполнять первичное стентирование.


 Рис.54. Коронарограммы правой коронарной артерии.
Рис.54. Коронарограммы правой коронарной артерии.
А – сложный продолженный стеноз 75% просвета в проксимальном сегменте; Б – имплантация стента длиной 26 мм; В – после стентирования.
Стентирование нашло широкое применение в лечении ИБС. К примеру, в 1997 году в мире было имплантировано более одного миллиона стентов. Также используется ангиопластика коронарных сосудов с помощью эксимерного лазера. Имеются сообщения о том, что наиболее эффективной является методика, сочетающая одновременную лазерную и баллонную ангиопластики. В последнее десятилетие широко применяются эндоваскулярные вмешательства на ранних стадиях острого инфаркта миокарда: интракоронарный тромболизис и баллонная дилатация.
В настоящее время достаточное распространение получила трансмиокардиальная лазерная реваскуляризация миокарда (ТМЛР).Впервые ТМЛР миокарда с помощью 80-Вт СО2–лазера выполнил Махмуд Мирхосейни в 1983 году в качестве дополнения к АКШ у 65-летнего мужчины. Ю.Ю. Бредикис в 1984 году первым произвел ТМЛР в виде самостоятельной операции на работающем сердце. Использовали высокоэнергетическую лазерную СО2-установку, синхронизированную с ЭКГ пациента. Показаниями к ТМЛР являются: неэффективность консервативной терапии при мелких нешунтабельных коронарных артериях, или тяжелое поражение дистального коронарного русла. Кроме этого, обязательное условие для ТМЛР – наличие ишемизированного, но жизнеспособного миокарда. При диффузном поражении коронарных артерий многим пациентам невозможно выполнить не только АКШ, но и ангиопластику. Идея использования ТМЛР основана на том, что каналы, образованные в стенке желудочка, соединяют миокард и его афферентные сосуды таким образом, что кровь напрямую поступает из полости левого желудочка в миокард. Эти манипуляции способствуют ангиогенезу. Л.А. Бокерия, И.И. Беришвили (2004) изучали клинико-физиологические механизмы эффективности трансмиокардиальной лазерной реваскуляризации и пришли к выводу, что комплекс изменений происходит поэтапно:“На первом этапе миокарду наносится минимальная травма, которая способствует некоторому усугублению ишемии миокарда и его денервации. Следующим этапом усугубление ишемии и лазер-специфическое воспаление индуцирует ангиогенез, который достигает клинической значимости через 3-6 мес. Последующее улучшение перфузии способствует симптоматическому улучшению состояния больных после ТМЛР”. Из всех других разработанных прежде методик трансмиокардиальной реваскуляризации (воздействие на миокард иглой, операция Вайнберга и некоторые другие), в настоящее время применяется только ТМЛР. Показания: 1) выраженное диффузное поражение коронарного русла и невозможность выполнения шунтирования и ангиопластики; 2) боли за грудиной и значительное снижение «качества жизни»; 3) стенокардия, рефрактерная к медикаментозной терапии. Обследование: традиционное ЭКГ в 12 стандартных отведениях, прекардиальное картирование, холтеровское мониторирование, Эхо-КГ в покое, стресс-ЭхоКГ (с ВЭМ или тредмилом, с добутамином и чреспищеводной стимуляцией левого предсердия), коронарография и вентрикулография. Сократительная способность миокарда левого желудочка оценивается также по общей фракции выброса (ОФВ) и степени нарушений локальной сократимости миокарда левого желудочка (по 16 сегментам, согласно методике, принятой Американской ассоциацией эхокардиографистов). Доступ к сердцу осуществляется через левостороннюю переднюю торакотомию в шестом межреберье. Операция проводится на бьющемся сердце с полным мониторингом гемодинамики под контролем чреспищеводной эхокардиографии. Используется эксимерный лазер Мах-20 (длина волны лазерного излучения 308 нм). Эксимерный лазер создает трансмиокардиальные каналы, вызывая некротические зоны минимального размера. Принципиально воздействие ТМЛР направлено на заднюю стенку левого желудочка и задние отделы межжелудочковой перегородки. Это обусловлено тем, что данные отделы в значительной степени влияют на сократимость левого желудочка. Каналы создаются по 1-3 на 1 см2 поверхности в зоне ишемии. Общее число каналов около 25±2,3.
Под лечебным ангиогенезом понимается применение факторов роста, стимулирующих развитие коллатеральных кровеносных сосудов при ишемии (Бокерия Л.А., 2000). Впервые J. Fiokman в 1971 году начал изучать процесс ангиогенеза. Он использовал гипотезу зависимости развития опухоли от васкуляризации. В последние годы установлен ряд факторов роста, стимулирущих (VEGF-сосудистый эндотелиальный фактор роста; FGF-фактор роста фибробластов; PDGF-тромбоцитозависимый фактор роста; HGF-фактор роста гепатоцитов; IL-8; TNF-a –фактор некроза опухоли; TGF-трансформирующий фактор роста; лептин) и блокирующих (эндостатин, ингиостатин, тромбосподин, IL-12) ангиогенез. Доказано, что ишемия, спазм, стеноз и воспаление способствуют не только развитию, но и росту коллатералей. Имеются сообщения о применении ангиогенеза для лечения ИБС у больных, которым невозможно осуществить реваскуляризацию миокарда, а также в качестве сочетания лечебного ангиогенеза с интервенционными и хирургическими методами. В связи с существующими вопросами продолжается активное изучение факторов, влияющих на ангиогенез.
Имеется немало сообщений о лечении ИБС с помощью эпидуральной высокочастотной электрической стимуляции спинного мозга. О рыбах-торпедах или электрических скатах, способных создавать парализирующие раскаты, известно с глубокой древности. Гиппократ рекомендовал принимать их в пищу для лечения астмы. Scriponius Largus, живший в Риме в 46 г.н.э. сообщил о том, что при помещении живого черного ската на голову, головная боль проходит. Впервые в 1774 году Джон Висли, пропустив электрический разряд через грудь больного стенокардией, получил выраженный эффект: «Пациент жаловался на сильные боли в желудке, но, проанализировав симптомы, я заключил, что это стенокардия (описанная доктором Геберденом). Я посоветовал ему больше не принимать лекарства, а пропустить электрический разряд через грудь. Симптомы сразу же исчезли, и он сладко заснул». Впервые стимуляцию спинного мозга (ССМ) для лечения стенокардии использовали D. Murphy и K. Giles в 1987 году. Применение ССМ базируется на «теории контроля входа», предложенной R. Melzack и P. Wall. Смысл ССМ заключается в том, что электростимуляция обладает способностью подавления проведения импульсов по волокнам симпатической нервной системы. Клинические наблюдения показали, что ССМ обладает несомненным эффектом, особенно у хронических больных ИБС, рефрактерных к другим методам лечения. Однако у многих больных эффективность ССМ кратковременная. До настоящего времени точный механизм ее действия не известен.
При дилатационной и ишемической кардиомиопатиях, сопровождающихся тяжелой сердечной недостаточностью, нашли применение операции кардиомиопластики с использованием специально тренированной поперечно-полосатой мышцы (m. latissimus dorsi) с сохраненным осевым типом кровоснабжения и иннервации через сосудисто-нервную ножку. Этой мышцей окутывается сердце, и она в значительной мере выполняет функцию левого желудочка. Система электрической стимуляции, которая состоит из электростимулятора, соединенного электродами с сердцем и широчайшей мышцей спины, обеспечивает синхронность сокращения мышцы с систолой сердца. Впервые в 1985 году эту операцию выполнил выдающийся французский хирург Алан Карпантье.
Таким образом, в настоящее время широко применяются следующие немедикаментозные методики лечения ИБС: рентгенохирургические (ангиопластика и стентирование); хирургические – коронарное шунтирование, МИРМ и ТМЛР; электростимуляция спинного мозга. При выборе наиболее адекватной методики учитываются также факторы риска. Естественно, что для лечения больной выбирает кардиолога и поэтому своевременность направления на операцию зависит от него. Тем не менее, пока еще очень много случаев запущенности кардиологических заболеваний. Внедрение современных технологий во все регионы позволит решить проблему лечения ИБС.
Дата добавления: 2014-12-14; просмотров: 1911;
