РЕАЛЬНЫЕ ГАЗЫ. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА.
При низких температурах и высоких давлениях поведение газов существенно отличается от поведения идеальных газов. Реальные газы при температурах ниже критической 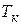 , в результате сжатия, переходят в жидкое состояние. Одно из уравнений, приближенно описывающих состояние реальных газов, – это уравнение Ван-дер-Ваальса
, в результате сжатия, переходят в жидкое состояние. Одно из уравнений, приближенно описывающих состояние реальных газов, – это уравнение Ван-дер-Ваальса
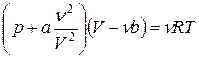 ,
,
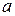 - поправка, учитывающая силы притяжения молекул,
- поправка, учитывающая силы притяжения молекул, 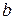 -поправка, учитывающая собственный объем молекул,
-поправка, учитывающая собственный объем молекул, 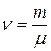 -число молей газа,
-число молей газа, 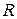 -газовая постоянная,
-газовая постоянная, 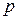 -давление газа,
-давление газа, 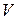 -объем сосуда, занимаемого газом.
-объем сосуда, занимаемого газом.
Поправки 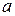 и
и 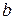 связаны с критической температурой
связаны с критической температурой 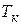 , критическим давлением
, критическим давлением 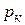 и критическим объемом
и критическим объемом 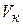 ,
,
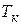 =
= 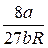 ,
, 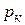 =
= 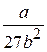 ,
, 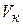 =
= 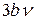 .
.
Дата добавления: 2014-12-13; просмотров: 961;
